
| 3.94g |
| 197g/mol |
| 2g |
| 8g |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 11 |
| 3 |
| 1 |
| 3 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
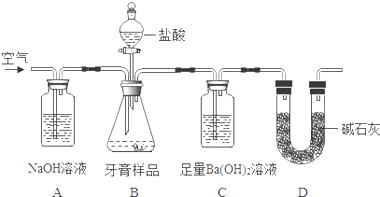
 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:
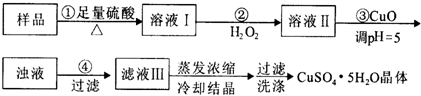
| A、利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B、步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O |
| C、洗涤:向装晶体的漏斗中加水至浸没晶体,待自然流下后重复2~3次 |
| D、某实验需要240 mL1mol/L的CuSO4溶液,则配制时需称量CuSO4?5H2O 60g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下
| ||
| B、向碳酸氢钙溶液中加入过量氢氧化钠溶液发生反应的离子方程式可表示为:Ca2++HCO3-+OH-═CaCO3↓+H2O | ||
| C、加入铝能放出H2的溶液中一定能大量存在Cu2+、Na+、NO3-、C1?四种离子 | ||
| D、常温下将0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
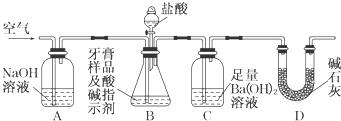
查看答案和解析>>
科目:高中化学 来源: 题型:
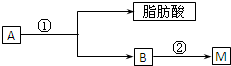
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
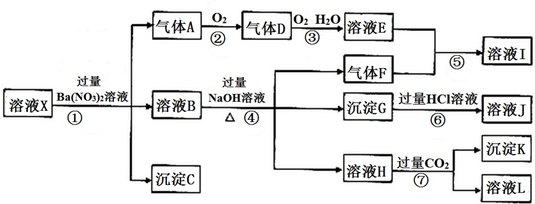
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素Z、W的简单离子的电子层结构不同 |
| B、元素的非金属性由强到弱:Y>Z>X |
| C、只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| D、元素Y的气态氢化物与其最高价氧化物对应的水化物不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com