
【题目】如右图所示,甲池的总反应式为:N2H4+O2=N2+2H2O,下列关于该电池工作时的说法正确的是
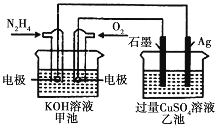
A. 该装置工作时,Ag电极上有气体生成
B. 甲池和乙池中的溶液的pH均减小
C. 甲池中负极反应为N2H4-4e-=N2+4H+
D. 当甲池中消耗0.1molN2H4时,乙池中理沦上最多产生6.4g固体
【答案】B
【解析】甲池作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑。A.通入肼的电极为电池的负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,A项错误;B.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,B项正确;C.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,C项错误;D.甲池消耗0.1molN2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,D项错误;故选B。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
A. 10 B. 34 C. 44 D. 78
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景
(1)如图是从海水中提取镁的简单流程. 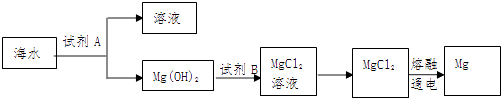
工业上常用于沉淀Mg2+的试剂A是 , Mg(OH)2转化为MgCl2的离子方程式是 .
(2)海带灰中富含以I﹣形式存在的碘元素,实验室提取I2的途径如下所示:
干海带 ![]() 海带灰
海带灰 ![]() 滤液
滤液 ![]()
![]()
![]() I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是 .
②反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图: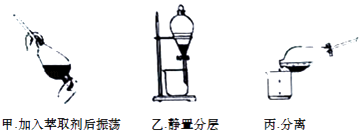
甲、乙、丙3步实验操作中,不正确的是(填“甲”、“乙”或“丙”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含0.2 mol KOH和0.1 mol Ba(OH)2的混合溶液中持续通入6.72 L(标况)CO2的过程中,溶液中离子的物质的量n和通入CO2体积V的关系示意图正确的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是
A. 硫酸钠是钠盐、硫酸盐、正盐
B. 硝酸是一元酸、强酸、挥发性酸
C. 氢氧化镁是二元碱、难溶性碱、中强碱
D. 三氧化硫是酸性氧化物、非金属氧化物、最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_______________________。
(2)加入NaClO3的作用是_________________________。
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液Ⅱ”中加入萃取剂的主要目的是_______________,使用萃取剂时最适宜的pH__________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.5.0~5.5 D.9.5~9.8

(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是________________________。
(6)某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。在电池充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将淀粉浆和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中.相当一段时间后,取袋内液体分别与碘水、新制Cu(OH) 2(加热)和浓HNO 3(微热)作用,其现象分别是( )
A.显蓝色、无现象、显黄色
B.显蓝色、红色沉淀、无现象
C.无现象、变黑色、显黄色
D.显蓝色、变红色、黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C. 加热0.1 mol·L-1Na2CO3溶液,CO![]() 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D. 对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com