


科目:高中化学 来源: 题型:
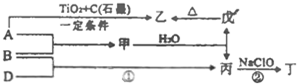 已知:A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件已略去).
已知:A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
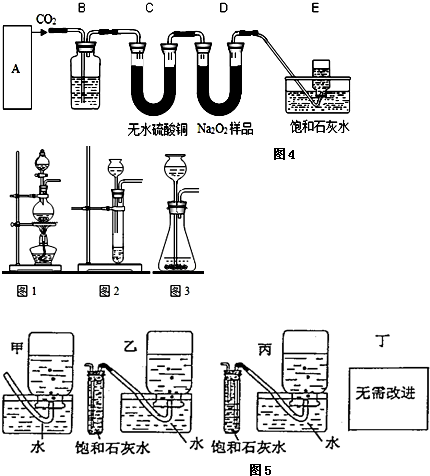
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素.但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等.请回答下列问题:
碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素.但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
65 29 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新能源与化石能源相比最直接的好处就是环境污染少 |
| B、利用晶体硅制作的太阳能电池可将太阳能直接转换为电能,实现太阳能的利用 |
| C、氢能是一种清洁的二次能源.可用电解水制氢的方法获取大量氢气实现能源的绿色化 |
| D、解决能源危机的方法是开源节流,即开发新能源和节约现有能源,提高原料的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com