
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)= ____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:
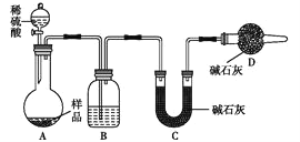
①B装置内所盛试剂是____________;
②D装置的作用是________。
③某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________。
【答案】坩埚 D 漏斗 44.2%或0.442合理即可 浓硫酸 防止空气中的水蒸气、CO2进入C装置 偏低 缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置(或其他合理答案
【解析】
(1)基本仪器的识别;
(2)混合物含量的测定、过滤操作等;
(3)实验方案的设计与评价以及误差分析等。
(1)用于灼烧的仪器为坩埚;
(2)①欲使碳酸根和碳酸氢根均完全沉淀,所以应加入含有氢氧根的溶液,结合给定的物质可知只能选用氢氧化钡溶液,即D;
②过滤时需要的玻璃仪器有烧杯、玻璃棒和漏斗;
③设碳酸钠和碳酸氢钠的物质的量分别为a、b,则可得106a+84b=9.5,197(a+b)=19.7,联立解得a=b=0.05mol,所以碳酸氢钠的质量分数为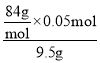 ×100%=44.2%;
×100%=44.2%;
(3)①根据实验目的可知B装置的作用是除去二氧化碳中的水蒸气,故选用浓硫酸;
②由于该方案是通过测定二氧化碳的质量进而确定物质的质量分数,因此为减小实验误差,D装置的作用是防止空气中的水蒸气、CO2进入C装置;
③由于系统内残留有二氧化碳,因此C装置测定的二氧化碳的质量偏低,从而导致碳酸氢钠的含量测定结果偏低;存在的明显缺陷为缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.中国的侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程可以表示如图所示(![]() 代表所需物质,
代表所需物质,![]() 代表产品)
代表产品)
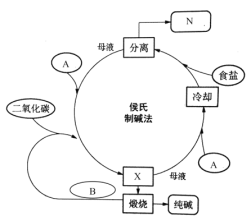
在上述工业流程中:
(1)产品N的化学式__________,所需物质A的名称____________,B的电子式____________。
(2)侯德榜制碱法的原理是_____________________________________(用化学方程式表示)。操作X的名称是_________________________。
II.利用侯德榜原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。
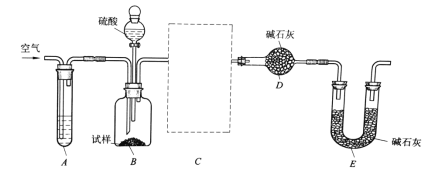
实验步骤如下:
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是__________________________。装置A中的液体应选用___________。
(4)装置B与D之间必须添加一装置C,否则使测定结果偏高。在空白框内画出该装置C,装置中盛放的是__________。
(5)根据此实验,计算出纯碱中Na2CO3的质量分数为_________________(用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会_________(“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是初中化学常见的物质:盐酸、氢氧化钠、氢氧化钙、碳酸钠、二氧化碳中的某一种。A可用于金属表面除锈,B可用来改良酸性土壤。它们相互之间发生反应或转化的关系如右图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化关系)。

(1)A、C的化学式分别为________、________;D在生活和生成中的一种用途是_________。
(2)E→D反应的化学方程式为_____________________________;B与D反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。
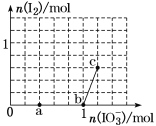
下列说法正确的是( )
A.0~b间的反应可用离子方程式3SO32-+IO3-=3SO42-+I-表示
B.a点时消耗的NaHSO3的物质的量为1.2 mol
C.b点到c点,KIO3与NaHSO3反应生成I2
D.当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构式如图,其中W、X、Y、Z为原子序数依次增大的短周期元素,Y原子核外最外层电子数是其电子层数的3倍,X与Z位于不同的周期,下列有关说法正确的是

A.气态氢化物的热稳定性:X>Y
B.X、W、Z三者形成的化合物都是液体
C.W2Y2中既含极性键又含非极性键
D.Z元素形成的含氧酸全部是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。回答下列有关氧化还原的问题。
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质(甲)为_________。(填化学式)
(2)反应中若产生标况下4.48LNO气体,则转移电子的数目是 ____________。
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
(1)用双线桥标出该反应的电子转移方向及数目:_______。氧化剂与还原剂的物质的量之比为______。
(2)测定NaNO2的质量分数的过程如下:称取NaNO2粗品0.6 g于锥形瓶中,先加水溶解,再向其中滴加0.1 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24mL。计算装置C中所得固体中NaNO2的质量分数___________。(已知测定过程中发生反应的方程式为MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平),且杂质不与KMnO4反应)
(3)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出两种方案。
①方案a:微碱性条件下用Fe(OH)2还原NO3-,产物为NH3。生成3.4g NH3同时会生成_____molFe(OH)3。
②方案b:碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,完成方程式并配平。
____Al+____NO3-+____ (____)—____AlO2-+______N2↑+____(____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
【答案】C
【解析】
根据题意需将SO32-氧化成SO42-,需加入氧化剂;
A.酸性高锰酸钾具有强氧化性,但是用H2SO4酸化,引入了SO42-,使测定结果偏大,故A错误;
B.0.5mol·L-1NaOH溶液中NaOH不是氧化剂,故B错误;
C.新制氯水可以将SO32-氧化成SO42-,故C正确;
D.KI溶液溶液中KI不是氧化剂,故D错误;
故答案为C。
【题型】单选题
【结束】
15
【题目】CO2气体中含有少量的SO2,欲用如图所示装置得到干燥纯净的CO2,则下列叙述正确的是( )
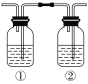
A.先让混合气体通过盛有NaOH溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②
B.先让混合气体通过盛有饱和NaHCO3溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②
C.先让混合气体通过盛有Na2CO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①
D.先让混合气体通过盛有饱和NaHCO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com