
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨作电极电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
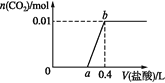
A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)= ____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:
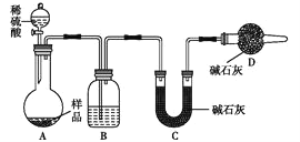
①B装置内所盛试剂是____________;
②D装置的作用是________。
③某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lwmol·L-1CH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图所示。下列叙述正确的是( )
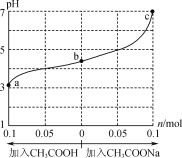
A.b点溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b点到a点的过程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
D.25℃时,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
A.上述过程中,最终被还原的是NO3-
B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述过程中,会产生一种无色的难溶于水的气体
D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2
【答案】B
【解析】
A.SO2通入硝酸铁稀溶液中,溶液由棕黄色变为浅绿色,是因为Fe3+与SO2发生氧化还原反应生成SO42-、Fe2+;溶液立即又变为棕黄色,是因为Fe2+与NO3-、H+发生氧化还原反应生成Fe3+,所以最终被还原的是NO3-,故A正确;
B.SO2能够被Fe3+氧化成H2SO4,Fe2+能够被稀硝酸氧化成Fe3+,则氧化性:稀硝酸>Fe3+>稀硫酸,故B错误;
C.稀溶液中,NO3-在酸性环境中被还原为NO,NO是无色的难溶于水的气体,故C正确;
D.上述过程中,最终被还原的是NO3-,故整个过程相当于SO2和NO3-之间发生了氧化还原反应,由关系式3SO2~2NO3-可知,SO2与NO的体积比为3∶2,故D正确;
故答案为B。
【题型】单选题
【结束】
14
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 9 月,我国科研人员研制出 Ti-H-Fe 双温区催化剂,其中 Ti-H 区域和Fe 区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是
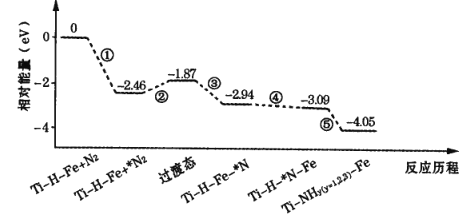
A.①②③在 Fe 区域发生,④⑤在Ti-H区域发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2. 46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti-H-Fe 双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com