
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。
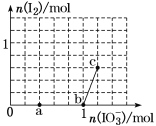
下列说法正确的是( )
A.0~b间的反应可用离子方程式3SO32-+IO3-=3SO42-+I-表示
B.a点时消耗的NaHSO3的物质的量为1.2 mol
C.b点到c点,KIO3与NaHSO3反应生成I2
D.当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08 mol
【答案】B
【解析】
A.根据还原性HSO3>I,氧化性IO3> I2,o~b, IO3氧化HSO3-生成I、SO42、H+,离子方程式为:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+,A项错误;
B.a点n(IO3)=0.4mol,根据离子方程式可得:n(NaHSO4)=3n(IO3)=3×0.4mol=1.2mol,B项正确;
C.b~c段,IO3氧化I生成I2,反应为IO3+5I+6H+=3I2+3H2O,C项错误;
D.氧化HSO3需要KIO3:1/3×3mol=1mol,生成I1mol,设氧化I的IO3为nmol,根据离子方程式可得氧化I的物质的量为5n mol,生成的I2物质的量为3n mol,则(1-5n):3n=5:3,得n=0.1mol,所以加入的KIO3共1.1mol,D项错误。
故答案选B。


科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是( )

A.可用BaCl2溶液除去粗盐中的SO![]()
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.试剂1可以选用石灰乳
D.工业上,通常电解氯化镁溶液来冶炼金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F各物质间转化关系如下图所示。A为常见气态烃,其产量可作为一个国家石油化工发展水平的标志,B和D是生活中常见有机物,D能跟Na2CO3溶液反应,F有香味。
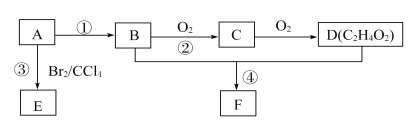
(1)E的结构简式为____________,实验室中②的反应条件是____________。
(2)A可合成高分子化合物PE,PE可用于制备保鲜膜、食品袋等,A合成PE的化学反应方程式为____________,该反应类型是____________。
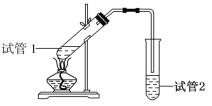
(3)实验室制备F时装置如图,试管2中所盛液体是饱和Na2CO3溶液。试管1中反应结束后,试管2中液体量比反应前增多且分层。振荡试管2后发现上层有机层液体变少,则振荡时发生的化学反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
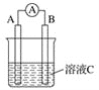
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )
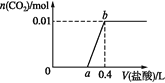
A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示的分析中,不正确的是( )
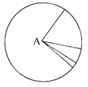

A. 如果该图为组成活细胞中的元素,则A是氧元素
B. 如果该图表示的是组成细胞的化合物,则A是蛋白质
C. 如果该图表示的是活细胞中的元素,则其中Mo的含量很少
D. 如果该图为组成细胞的有机化合物,则A中肯定含有的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)= ____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:
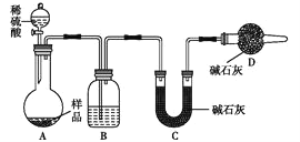
①B装置内所盛试剂是____________;
②D装置的作用是________。
③某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lwmol·L-1CH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图所示。下列叙述正确的是( )
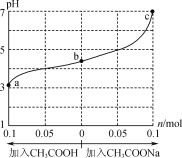
A.b点溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b点到a点的过程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
D.25℃时,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com