
【题目】下列离子方程式正确的是( )
A.强碱性溶液中NaClO将Fe(OH)3氧化为FeO42-:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
B.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为 。
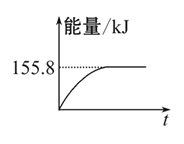
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如图所示,下列说法正确的是

A.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
B.同物质的量的CO和O反应比CO与O2反应放出更多的热量
C.CO和O生成CO2是吸热反应
D.在该过程中,CO断键形成C和O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为
①Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
②Ni(CO)4(g)![]() Ni(s)+4CO(g) ΔH>0
Ni(s)+4CO(g) ΔH>0
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____、____。
(2)已知在一定条件下2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为_____。
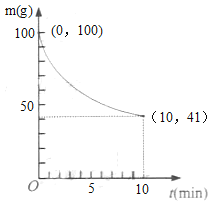
(3)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时___。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(二)已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
(1)下列示意图正确且能说明反应达到平衡状态的是___。
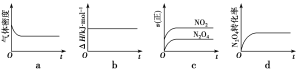
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数____(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率υ(N2O4)=___mol·L-1·s-1。
(3)达到平衡后,若向该恒压容器中再充入0.5molHe,则平衡将__(填“向左移动”“向右移动”或“不移动”)。
(4)该反应在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___(填字母序号)。
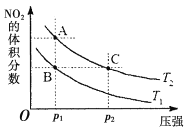
a.A、C两点气体的颜色:A深,C浅
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法
(三)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
已知:
①C4H10(g) ![]() C4H8(g)+H2(g) ΔH1
C4H8(g)+H2(g) ΔH1
②C4H10(g)+![]() O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ·mol-1
O2(g)=H2O(g) ΔH3=-242kJ·mol-1
反应①的ΔH1为____kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x___0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
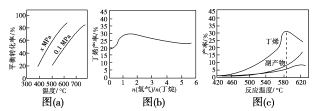
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,所属关系不符合“X包含Y、Y包含Z”的有
选项 | X | Y | Z |
A | 芳香族化合物 | 芳香烃的衍生物 |
|
B | 脂肪族化合物 | 链状烃的衍生物 | CH3COOH(乙酸) |
C | 环状化合物 | 芳香族化合物 | 苯的同系物 |
D | 不饱和烃 | 芳香烃 |
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g) ![]() N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com