
【题目】(一)镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为
①Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
②Ni(CO)4(g)![]() Ni(s)+4CO(g) ΔH>0
Ni(s)+4CO(g) ΔH>0
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____、____。
(2)已知在一定条件下2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为_____。
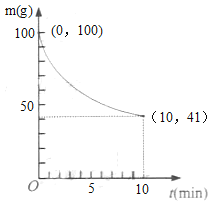
(3)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时___。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(二)已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
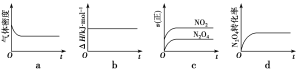
(1)下列示意图正确且能说明反应达到平衡状态的是___。
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数____(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率υ(N2O4)=___mol·L-1·s-1。
(3)达到平衡后,若向该恒压容器中再充入0.5molHe,则平衡将__(填“向左移动”“向右移动”或“不移动”)。
(4)该反应在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___(填字母序号)。
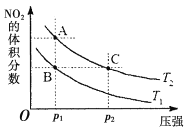
a.A、C两点气体的颜色:A深,C浅
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法
(三)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
已知:
①C4H10(g) ![]() C4H8(g)+H2(g) ΔH1
C4H8(g)+H2(g) ΔH1
②C4H10(g)+![]() O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ·mol-1
O2(g)=H2O(g) ΔH3=-242kJ·mol-1
反应①的ΔH1为____kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x___0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
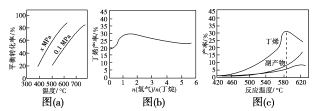
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__。
【答案】增大CO浓度 加压 0.05 mol·L-1·min-1 bc ad 不变 0.1 向左移动 bd +123 小于 AD 氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
【解析】
(一)
(1)反应Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0是放热反应,正反应气体体积减小,依据平衡移动原理分析;
Ni(CO)4(g) ΔH<0是放热反应,正反应气体体积减小,依据平衡移动原理分析;
(2)粗镍的纯度98.5%,1~10min内粗镍质量减少100g-41g═59g;由于杂质与CO不反应,依据化学方程式计算Ni(CO)4物质的量得到变化浓度,根据化学反应速率概念计算得到;
(3)反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,υ逆[Ni(CO)4]减小;
(二)
(1)根据反应的特点和化学平衡的标志分析作答;
(2)平衡常数是温度的函数,只受温度影响,故平衡常数不变;先利用公式计算υ(NO2),再用化学反应速率之比等于化学计量数之比;
(3)恒温恒压时充入稀有气体,容器容积增大,各反应成分浓度降低,反应速率减小,平衡向气体体积增大的方向移动。
(4)a.相同温度下,增大压强达到新的平衡,体系中各种物质的浓度均增大,体系颜色变深,即A浅,C深,a错误;b.增大压强,平衡右移,二氧化氮的转化率增大,b正确;c. 根据图像,B、C两点所处平衡状态中各组分的体积分数分别相等,即它们的平均相对分子质量相等,c错误;d. 该反应的正反应为放热反应,升高温度平衡逆向移动,NO2体积分数增大,则T1<T2,可以通过加热的方法由状态B移动到状态A,d正确;
(三)
(1)根据盖斯定律,②式-③式可得①式的△H1;由(a)图定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;
(2)丁烷分解产生丁烯和氢气,增加氢气的量,①的逆反应速率增大,丁烯的产率下降。
(一)
(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、增大CO浓度等措施均可使反应正向进行,提高Ni(CO)4的产率;故答案为:增大CO浓度;加压;
(2)1~10min内粗镍质量减少100g-41g═59g;由于杂质与CO不反应,则反应的镍的物质的量为59g÷59g/mol=1mol,在0~10min内生成Ni(CO)4的物质的量为1mol,故在0~10min,υ[Ni(CO)4]= ![]() =0.05 mol·L-1·min-1;故答案为:0.05 mol·L-1·min-1;
=0.05 mol·L-1·min-1;故答案为:0.05 mol·L-1·min-1;
(3)反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向移动;
a. 温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向移动,平衡常数减小,a错误;
b. 温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向移动,一氧化碳浓度减小,b正确;
c. 依据反应分析,温度降低反应②逆向移动,镍质量减小,c正确;
d.温度降低,υ逆[Ni(CO)4]减小,d错误;
故答案为:bc;
(二)
(1)a.正反应是气体分子数减小的反应,在温度和压强恒定的条件下,建立平衡过程中容器体积变大,气体质量不变,则气体密度变小,达到了平衡状态时混合气的密度不变,故a正确;
b.反应热ΔH只与反应方程式有关,是一个不变量,H不变不能说明反应达到平衡状态,故b错误;
c.图示NO2和N2O4表示的都是正反应速率,两者表示的正反应速率之比始终等于2:1,不能判断反应是否达到平衡状态,故c错误;
d.开始N2O4的转化率在增大,后来转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
正确答案是ad;
(2)平衡常数是温度的函数,只受温度影响,由于温度不变,故平衡常数不变。由题意可知,υ(NO2)=0.6mol÷1L÷3s=0.2molL-1s-1,化学反应速率之比等于化学计量数之比,故υ(N2O4)=0.1molL-1s-1;
(3)恒压容器中再充入He,体积增大,相当于减压,平衡向左移动;
(4)a. 相同温度下,增大压强虽然平衡正向移动,但体系中各种物质的浓度均增大,体系颜色变深,即A浅,C深,a错误;
b.增大压强,平衡右移,二氧化氮的转化率增大,转化率A<C,b正确;
c. 根据图像,B、C两点所处平衡状态中各组分的体积分数分别相等,即它们的平均相对分子质量相等,c错误;
d. 该反应的正反应为放热反应,升高温度平衡逆向移动,NO2体积分数增大,则T1<T2,可以通过加热的方法由状态B移动到状态A,d正确;
故选bd。
(三)
(1)②C4H10(g)+![]() O2(g)=C4H8(g)+H2
O2(g)=C4H8(g)+H2![]() O2(g)=H2O(g) ΔH3=-242kJ·mol-1,②③得①式C4H10(g)=C4H8(g)+H2(g) ΔH1= +123kJmol1;由(a)图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①的正向体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,故答案为:+123;小于;AD;
O2(g)=H2O(g) ΔH3=-242kJ·mol-1,②③得①式C4H10(g)=C4H8(g)+H2(g) ΔH1= +123kJmol1;由(a)图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①的正向体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,故答案为:+123;小于;AD;
(2)丁烷分解产生丁烯和氢气,开始氢气量较少时,氢气的作用是活化催化剂,氢气是反应①的产物之一,增大氢气的量,逆反应速率增大,丁烯的产率降低,故答案为:氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,1.68L无色的可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)燃烧产物中水的质量为_____g。
(2)若原气体是单一气体,则其分子式为_____,若将该气体设计成碱性(KOH)燃料电池,请写出负极反应式_____。
(3)若原气体是由两种等物质的量的气态烃组成的混合物,请写出它们的分子式________。(请写出两组)
(4)若原气体是由两种等物质的量的气体组成的混合物,其中只有一种是烃,请写出它们的分子式______。(请写出两组)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
C.用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
D.用甘氨酸和丙氨酸缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
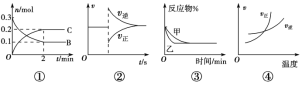
A.对反应:aA(s)+2B(g) ![]() xC(g),根据图①可以求出x=2
xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.强碱性溶液中NaClO将Fe(OH)3氧化为FeO42-:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
B.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所下列化学用语的理解正确的是( )
A.比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式![]() H既可以表示羟基,也可以表示氢氧根离子
H既可以表示羟基,也可以表示氢氧根离子
C.丙烯的最简式可表示为CH2
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:8
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得![]() 溶液
溶液![]() ,平衡时碳的分布系数
,平衡时碳的分布系数![]() 各含碳微粒的浓度占含碳各种微粒浓度之和的分数
各含碳微粒的浓度占含碳各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
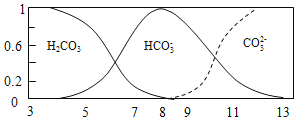
A.常温下,![]()
B.![]() 时,溶液中不存在
时,溶液中不存在![]() 的水解平衡
的水解平衡
C.pH由![]() 时,随着pH值的增大,
时,随着pH值的增大,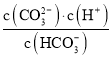 增大
增大
D.![]() 时,有
时,有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,碳酸(H2CO3)的电离常数Ka1=4.5×10-7、Ka2=5.0×10-11。常温下,向20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1的盐酸40mL,溶液中含碳元素各微粒(CO2因逸出未画出)的物质的量分数随溶液pH的变化如图所示,下列说法错误的是( )

A.随着盐酸的加入,溶液中![]() 的值增大
的值增大
B.加入盐酸至溶液pH=8的过程中,水的电离程度逐渐减小
C.当pH=7时,溶液中c(Na+)>c(HCO3-)>cCl-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com