
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
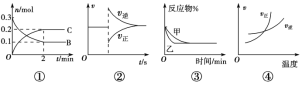
A.对反应:aA(s)+2B(g) ![]() xC(g),根据图①可以求出x=2
xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
科目:高中化学 来源: 题型:
【题目】某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
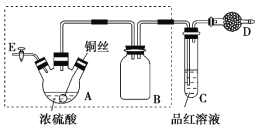
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________。
(2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。
(3)装置A中发生反应的化学方程式为____________________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物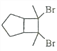 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族硼、稼及其化合物在材料科学领域有广泛应用。
(1)基态硼原子电子排布图为___。
(2)常温下,Ga(CH3)3呈液态。在高温条件下,Ga(CH3)3和AsH3反应可制备半导体材料GaAs和另一产物为M,
①M是__分子(填“极性”或“非极性”);Ga(CH3)3中Ga原子和C原子构成的空间构型是__。
②Ga(CH3)3的晶体类型是__晶体;B、Ga和As均属于__区元素(填字母)。
A.s B.p C.d D.ds
(3)硼酸(H3BO3)是层状结构晶体(如图甲所示),在冷水中溶解度很小,加热时溶解度增大。
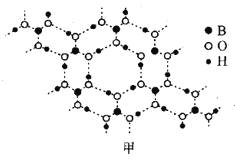
①硼酸晶体中存在的作用力有__(填字母)。
a.σ键极 b.π键 c.氢键 d.范德华力
②硼酸在水中溶解度随着温度升高而增大的主要原因可能是__。
(4)NaBH4、LiBH4常作有机合成的还原剂,其中B原子的杂化轨道类型是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞如图乙所示。已知:P-B键键长为Rnm,NA是阿伏加德罗常数的值。
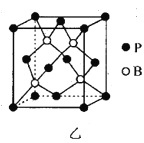
①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为___nm。
②BP晶体密度为__g·cm-3(用含R和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过如图所示途径合成: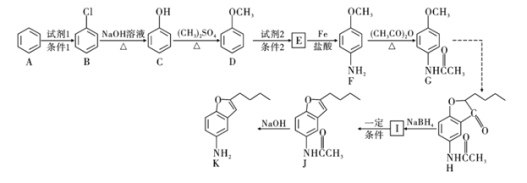
已知:![]()
![]() ;
;![]() 苯胺易被氧化
苯胺易被氧化![]() ;
;
![]()
![]() 。
。
回答下列问题:
(1)写出化合物D的名称为______________,F中的非含氧官能团名称为______________
(2)写出![]() 的反应类型:______________,化合物G的分子式为______________。
的反应类型:______________,化合物G的分子式为______________。
(3)写出![]() 反应的化学方程式:__________________________________________。
反应的化学方程式:__________________________________________。
(4)化合物L是E同分异构体,写出同时满足下列条件L的其中一种结构简式:____________________________。
①能与![]() 溶液反应显紫色
溶液反应显紫色
②苯环上有三个取代基,其中一个为![]()
③苯环上的一氯取代有两种同分异构体
(5)合成途径中,F转化为G的目的是___________________________________。
(6)参照上述合成路线,以苯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备![]() 的合成路线。________________
的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟石油深加工来合成丙烯酸乙酯等物质的过程,请回答下列问题:
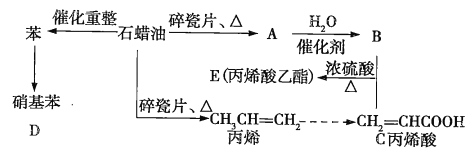
(1)A的结构简式为__________________。
(2)写出B+C→E的化学方程式:____________________________________,反应类型为__________________。
(3)在催化剂条件下,由丙烯酸还可生成聚丙烯酸塑料,写出该反应的化学方程式:______________________________,反应类型为______________________________。
(4)写出由苯生成硝基苯的化学方程式:______________________________,反应类型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )

A. 4︰1B. 3︰1C. 2︰1D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.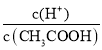 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是________。
(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,醋酸的电离平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________mol·L-1(用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)变为b mol·L-1,则此时c2(H+)=________(用含a、b的代数式表示)mol·L-1。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com