
【题目】第ⅢA族硼、稼及其化合物在材料科学领域有广泛应用。
(1)基态硼原子电子排布图为___。
(2)常温下,Ga(CH3)3呈液态。在高温条件下,Ga(CH3)3和AsH3反应可制备半导体材料GaAs和另一产物为M,
①M是__分子(填“极性”或“非极性”);Ga(CH3)3中Ga原子和C原子构成的空间构型是__。
②Ga(CH3)3的晶体类型是__晶体;B、Ga和As均属于__区元素(填字母)。
A.s B.p C.d D.ds
(3)硼酸(H3BO3)是层状结构晶体(如图甲所示),在冷水中溶解度很小,加热时溶解度增大。
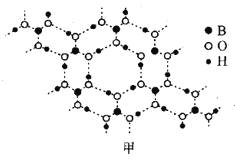
①硼酸晶体中存在的作用力有__(填字母)。
a.σ键极 b.π键 c.氢键 d.范德华力
②硼酸在水中溶解度随着温度升高而增大的主要原因可能是__。
(4)NaBH4、LiBH4常作有机合成的还原剂,其中B原子的杂化轨道类型是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞如图乙所示。已知:P-B键键长为Rnm,NA是阿伏加德罗常数的值。
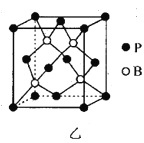
①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为___nm。
②BP晶体密度为__g·cm-3(用含R和NA的代数式表示)。
【答案】![]() 非极性 平面三角形 分子 p acd 升高温度,硼酸分子间氢键被破坏 sp3杂化
非极性 平面三角形 分子 p acd 升高温度,硼酸分子间氢键被破坏 sp3杂化 ![]() R
R ![]()
【解析】
(1)基态硼原子的原子序数为5,核外电子分别位于1s、2s、2p能级;
(2)①根据元素守恒及原子守恒知,M为![]() ,
,![]() 中Ga原子价层电子对个数为3且不含孤电子对;
中Ga原子价层电子对个数为3且不含孤电子对;
②分子晶体熔沸点较低,该分子熔沸点较低,为分子晶体;B、Ga和As最后排入的电子为p电子;
(3)①硼酸晶体中![]() 、
、![]() 原子之间存在共价单键,为
原子之间存在共价单键,为![]() 键极,分子之间存在范德华力,分子间氢键导致存在硼酸大分子;
键极,分子之间存在范德华力,分子间氢键导致存在硼酸大分子;
②升高温度,硼酸分子间氢键被破坏;
(4)NaBH4、LiBH4的阴离子中B原子价层电子对个数4,不含孤电子对;
(5)①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为晶胞面对角线长度的一半;
②依据分摊法和密度计算公式可得。
(1)基态硼原子的原子序数为5,核外电子分别位于1s、2s、2p能级,电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①根据元素守恒及原子守恒知,M为![]() ,甲烷为正四面体结构,其正负电荷中心重合,所以为非极性分子;Ga原子最外层3个电子,
,甲烷为正四面体结构,其正负电荷中心重合,所以为非极性分子;Ga原子最外层3个电子,![]() 中Ga原子价层电子对个数为3且不含孤电子对,据此判断Ga和C原子构成的空间构型为平面三角形,故答案为:非极性;平面三角形;
中Ga原子价层电子对个数为3且不含孤电子对,据此判断Ga和C原子构成的空间构型为平面三角形,故答案为:非极性;平面三角形;
②分子晶体熔沸点较低,该分子熔沸点较低,为分子晶体;B、Ga和As最后排入的电子为p电子,所以均属于p区元素,故答案为:分子晶体;p;
(3)①硼酸晶体中![]() 、
、![]() 原子之间存在共价单键,为
原子之间存在共价单键,为![]() 键极,分子之间存在范德华力,分子间氢键导致存在硼酸大分子,所以存在
键极,分子之间存在范德华力,分子间氢键导致存在硼酸大分子,所以存在![]() 键、氢键、范德华力,故答案为:acd;
键、氢键、范德华力,故答案为:acd;
②升高温度,硼酸分子间氢键被破坏,所以硼酸在水中溶解度随着温度升高而增大,故答案为:升高温度,硼酸分子间氢键被破坏;
(4)NaBH4、LiBH4的阴离子中B原子价层电子对个数![]() ,且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化轨道类型为
,且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化轨道类型为![]() 杂化,故答案为:
杂化,故答案为:![]() 杂化;
杂化;
(5)①P-B键键长为Rnm,![]() 键长等于晶胞体对角线长度的
键长等于晶胞体对角线长度的![]() ,晶胞体对角线长度为4Rnm,则晶胞长度
,晶胞体对角线长度为4Rnm,则晶胞长度![]() ,该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为晶胞面对角线长度的一半,则正四面体的边长
,该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为晶胞面对角线长度的一半,则正四面体的边长![]() ,故答案为:
,故答案为:![]() ;
;
②晶胞体积![]() ,P原子个数
,P原子个数![]() 、B原子个数为4,BP晶体密度
、B原子个数为4,BP晶体密度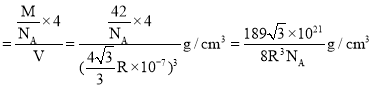 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: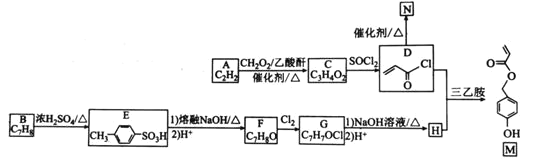
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备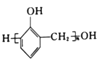 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如下:

回答下列问题:
(1)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式____________。
(2)在溶液I中加入NaOH固体的目的是_______(填字母)。
A.与反应液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图1为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4的生成率的影响。

工业生产中最佳温度为_______,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为_____。
(4)反应③中的离子反应方程式为_________________;溶液Ⅱ中加入饱和KOH得到湿产品的原因是__________________。
(5)高铁酸钾作为水处理剂是能与水反应其离子反应是:4FeO42-+l0H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①_______________;②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。

回答下列问题:
(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________。操作Ⅰ的名称为_________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________{列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )
A.对反应:aA(s)+2B(g) ![]() xC(g),根据图①可以求出x=2
xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
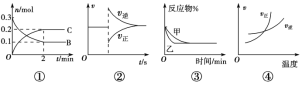
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
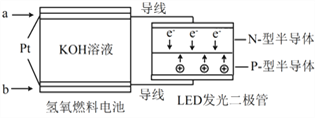
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com