
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
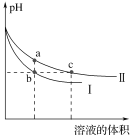
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
【答案】B
【解析】
NaOH是强碱,而CH3COONa溶液中存在水解平衡,所以相同pH溶液进行稀释时,CH3COONa溶液的pH变化比较平缓,所以曲线II为CH3COONa稀释曲线。
A.任一点溶液中均存在电荷守恒:c(OH)+c(CH3COO-)=c(H+)+c(Na+),依据物料守恒有: c(CH3COO-)+c(CH3COOH)=c(Na+),将两式相减得:c(H+)+c(CH3COOH)=c(OH)。如所给的等式c(OH)+c(CH3COOH)=c(H+)成立,则可得出c(CH3COOH)=0这一错误的结论,A项错误;
B.开始两溶液的pH相同,则开始物质的量浓度:CH3COONa>NaOH,a、b两点溶液稀释的倍数相同,所得对应溶液中的离子浓度:CH3COONa>NaOH,导电性:a>b, B项正确;
C.b、c两点溶液中pH相同,但一个是碱溶液,水的电离受到抑制,一个是强碱弱酸盐的溶液,水的电离因CH3COO-水解而受到促进,所以水的电离程度:b<c, C项错误;
D.盐类的水解是微弱的,所以稀释前NaOH溶液与CH3COONa溶液中溶质的物质的量:n(CH3COONa)>n(NaOH),所以用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应时,消耗盐酸的体积:Vb<Vc,D项错误;
所以答案选择B项。


科目:高中化学 来源: 题型:
【题目】工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______________,b___________________。
(2)A中反应的化学方程式为____________。
(3)装置B中加入的试剂是_____________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置______和 ________(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是___________________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。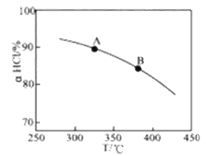
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
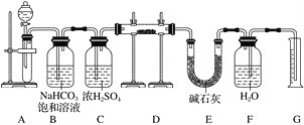
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 10gNH3含有4NA个电子
B. 0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C. 标准状况下,22.4 L H2O中分子数为NA 个
D. 1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种化合物的溶解度随温度变化曲线如图所示,下列说法正确的是( )
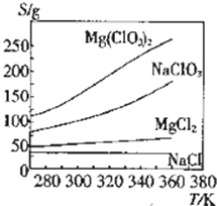
A.NaClO3的溶解是放热过程
B.由图中数据可求出300K时MgCl2饱和溶液的物质的量浓度
C.可采用复分解反应制备Mg(ClO3)2:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
D.若NaCl中含有少量Mg(ClO3)2,可用降温结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式,正确的是( )
A. 稀硝酸和过量的铁屑反应:Fe+4H++ NO3-= Fe3++NO↑+2H2O
B. NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH- = CO32-+H2O
C. 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+= Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
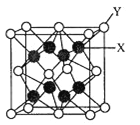
(1)E在同期表中的位置是_______,其基态原子的简化电子排布式为____________。
(2)CB![]() 的立体构型是______。
的立体构型是______。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为____(填离子符号);D2C的熔点比CaF2熔点__________________(填“高”、“低”或“无法比较”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com