
【题目】A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E在同期表中的位置是_______,其基态原子的简化电子排布式为____________。
(2)CB![]() 的立体构型是______。
的立体构型是______。
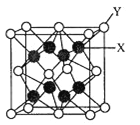
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为____(填离子符号);D2C的熔点比CaF2熔点__________________(填“高”、“低”或“无法比较”)。
【答案】第四周期VIII族 [Ar]3d64s2 三角锥型 S2- 低
【解析】
根据题目所述,A基态原子的核外电子占据4个原子轨道,只能为1s22s22p2,A为碳元素。大气平流层中单质B3浓度减少会致人患皮肤癌增加,故B元素为氧元素。D是前四周期元素中第一电离能最小的元素,同周期元素,从左到右,第一电离能逐渐增大,D元素为钾元素。E的合金是当今用量最大的合金,E为铁元素。又因为B、C为同主族元素,C只能为硫元素。结合物质结构知识解答。
(1)E在同期表中的位置是第四周期,VIII族,其基态原子的简化电子排布式为 [Ar]3d64s2。故答案为:第四周期VIII族;[Ar]3d64s2;
(2)CB![]() 为SO32-,中心原子为S,价层电子对数为4,含有一对孤电子对,硫原子采取sp3,杂化所以其立体构型是三角锥型。
为SO32-,中心原子为S,价层电子对数为4,含有一对孤电子对,硫原子采取sp3,杂化所以其立体构型是三角锥型。
故答案为:三角锥型;
(3)根据图中所示,晶胞计算后可知,Y:X=2:1,即Y为C,X为D元素。通过题目解析可知,C为硫元素,故Y应为S2-。D2C为K2S,与CaF2都为离子晶体,所以其熔点高低取决于化合物之间的离子键强度,离子键强度高,熔点高。离子键强度的决定因素:①.离子带电荷越大,离子键越强。②.离子半径越小,离子键越强。③.形成离子键两键结原子的电负性差较大者,离子键较强。这里CaF2的电负性差较大,故CaF2熔点高。
故答案为:S2-;低。


科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
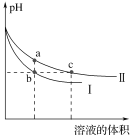
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧,硫,硒(Se),碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______。
![]()
(2)Se原子序数为______,其核外M层电子的排布式为______。
(3)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________。
②H2SeO4比H2SeO3酸性强的原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按所给的要求,回答下列问题:
(1)BC13和NC13中心原子的杂化方式分别为______和____。第一电离能介于B、N之间的第二周期元素有______种。
(2)F-、K+和Fe3+三种离子组成的化合物K3FeF6,其中化学键的类型有______;该化合物中存在一个复杂的离子该离子的化学式为______,作配位体的原子是______;
(3)HCHO分子中既含σ 键又含π键______(填“正确”或“错误”) 。
(4)下列物质变化,只与范德华力有关的是(______)
A 干冰升华 B 乙醇汽化 C 乙醇与丙酮混溶 D 氯化钠溶于水 E 碘溶于四氯化碳 F 石英熔融
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入Cl2(溶液体积变化忽略不计),生成I2、Fe3+的物质的量随通入Cl2的物质的量的变化如图所示,下列说法错误的是( )
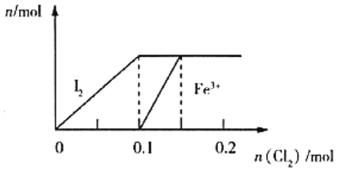
A.还原性强弱:Fe2+<I-
B.n(Cl2)=0.05mol时,溶液中I-的物质的量浓度为0.1mol·L-1
C.若n(Cl2):n(FeI2)=6:5,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
D.n(Cl2)=0.12mol时,溶液中的离子主要有Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备如下所示,下列说法正确的是
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
A.步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.灼烧熔融的Na2CO3固体,可用石英坩埚
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com