
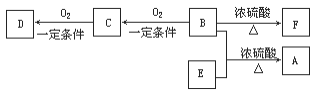
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: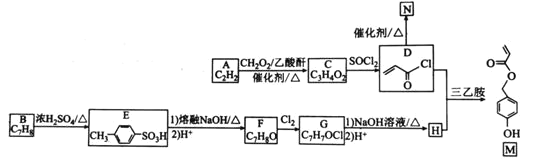
已知:![]()
回答下列问题:
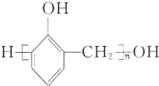
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备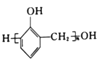 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
【答案】甲苯 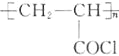 加成反应 氯原子、
加成反应 氯原子、![]() 酚
酚![]() 羟基 光照
羟基 光照 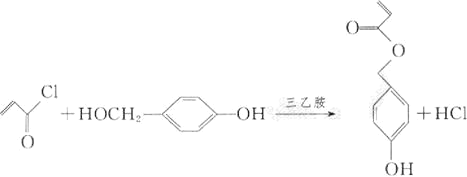
![]()
![]()
【解析】
A只能是乙炔,根据分子式和E的结构不难推出B为甲苯,C是丙烯酸,F为对甲基苯酚,G为侧链上的氢原子被氯原子取代后的产物,而G在碱的水溶液中水解可以形成醇H,H和D发生取代反应即可得到产物M。
(1)由E的结构简式可推出,B发生磺化反应生成E,则B的化学名称为:甲苯,D发生加成反应得到N,N的结构简式为: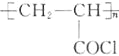 ;
;
(2)A(![]() )与
)与![]() 的分子式相加刚好得到C的分子式
的分子式相加刚好得到C的分子式![]() ,故反应类型为加成反应,由E可得F应为对甲基苯酚,G为F中甲基上一个氢原子被氯原子取代的产物,故G中官能团的名称为:氯原子、酚羟基;
,故反应类型为加成反应,由E可得F应为对甲基苯酚,G为F中甲基上一个氢原子被氯原子取代的产物,故G中官能团的名称为:氯原子、酚羟基;
(3)G为F中甲基上一个氢原子被氯原子取代的产物,由F转化为G是与![]() 的取代反应,故条件为光照;
的取代反应,故条件为光照;
(4)由D和H生成M的化学方程式为: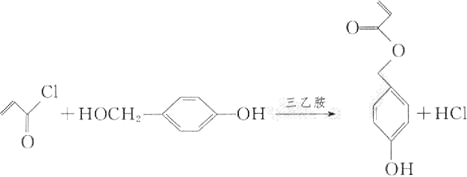 ;
;
(5)X是M的同分异构体,①能与![]() 溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,1molX最多生成4molAg,说明有两个醛基,③核磁共振氢谱中有5组吸收峰,说明有5个等效氢,故同时满足以上条件的X的结构有5种,分别为:
溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,1molX最多生成4molAg,说明有两个醛基,③核磁共振氢谱中有5组吸收峰,说明有5个等效氢,故同时满足以上条件的X的结构有5种,分别为: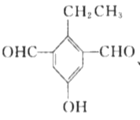 、
、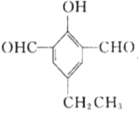 、
、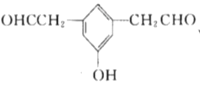 、
、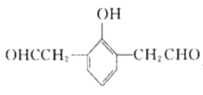 、
、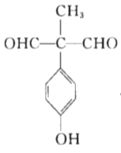 ,故答案为5;
,故答案为5;
(6)参照上述合成路线和信息,设计以苯和甲醛为原料![]() 无机试剂任选
无机试剂任选![]() ,制备
,制备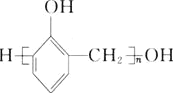 的合成路线:
的合成路线:![]()
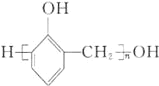 。
。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=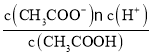 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=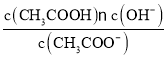 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,水的离子积常数KW=1.0×10-12,请回答下列问题:
(1)此温度___25℃(填“>”、“<”或“=”),原因是___。
(2)对水进行下列操作,能抑制水的电离的是___。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)=__。
(4)醋酸的下列性质中,可以证明它是弱电解质的是___。
①1mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL1mol/L的CH3COOH恰好与10mL1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO-、H+同时存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:

已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列问题:
(1)“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
(2)“分铜渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
(4)从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
(5)向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
(6)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知![]() =2.25)。
=2.25)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
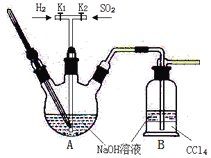
已知:2NaHSO3![]() Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物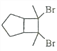 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。
ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
ⅳ.F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有_______(选填序号)。
a.取代反应 b.加聚反应 c.消去反应 d.氧化反应
(2)D、F分子所含的官能团的结构简式依次是_______、________。
(3)写出与D、E具有相同官能团的一种同分异构体的结构简式___________。
(4)写出B和E反应生成A的化学方程式是_______________。
(5)写出C与新制Cu(OH)2反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族硼、稼及其化合物在材料科学领域有广泛应用。
(1)基态硼原子电子排布图为___。
(2)常温下,Ga(CH3)3呈液态。在高温条件下,Ga(CH3)3和AsH3反应可制备半导体材料GaAs和另一产物为M,
①M是__分子(填“极性”或“非极性”);Ga(CH3)3中Ga原子和C原子构成的空间构型是__。
②Ga(CH3)3的晶体类型是__晶体;B、Ga和As均属于__区元素(填字母)。
A.s B.p C.d D.ds
(3)硼酸(H3BO3)是层状结构晶体(如图甲所示),在冷水中溶解度很小,加热时溶解度增大。
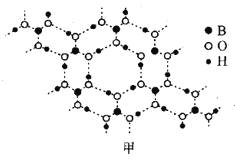
①硼酸晶体中存在的作用力有__(填字母)。
a.σ键极 b.π键 c.氢键 d.范德华力
②硼酸在水中溶解度随着温度升高而增大的主要原因可能是__。
(4)NaBH4、LiBH4常作有机合成的还原剂,其中B原子的杂化轨道类型是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞如图乙所示。已知:P-B键键长为Rnm,NA是阿伏加德罗常数的值。
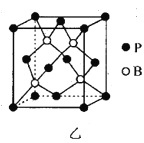
①该晶胞中B原子位于P原子形成的正四面体的体心,该正四面体的边长为___nm。
②BP晶体密度为__g·cm-3(用含R和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).
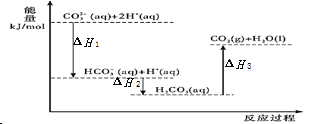
A.△H1 >△H2 ; △H2<△H3
B.反应 ![]() (aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
(aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
C.![]() (aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3 变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com