
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=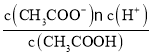 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=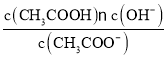 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
【答案】Ka·Kh=KW 越大 ![]() mol/L 溶液的pH 酸碱中和滴定 酸碱中和滴定 < c(Na+)>c(CN-)>c(OH-)>c(H+)
mol/L 溶液的pH 酸碱中和滴定 酸碱中和滴定 < c(Na+)>c(CN-)>c(OH-)>c(H+)
【解析】
(1)根据弱酸的电离平衡常数表达式、对应离子的水解常数表达式及水的离子积常数之间的关系式判断;根据电离平衡常数和水解常数的关系判断;
(2)根据醋酸的电离平衡常数表达式分析;
(3)根据Ka=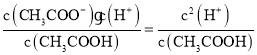 确定需要测量是数据;
确定需要测量是数据;
(4)Z根据水解平衡常数Kh(CN-),结合K Ka·Kh=KW计算Ka(HCN),然后比较Kh(CN-)、Ka(HCN),判断CN-的水解能力强于HCN的电离能力,据此分析解答。
(1)醋酸的电离平衡常数Ka=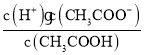 ,醋酸根离子水解平衡常数为Kh=
,醋酸根离子水解平衡常数为Kh=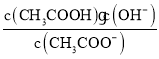 ,Ka·Kh=Kw,根据三者之间的关系式知,弱电解质的电离程度越小,其对应的离子水解程度越大;
,Ka·Kh=Kw,根据三者之间的关系式知,弱电解质的电离程度越小,其对应的离子水解程度越大;
(2)由于醋酸电离出的醋酸根离子与氢离子浓度近似相对,平衡时醋酸又可以看成是醋酸溶液的浓度,所以(H+)=![]() ;
;
(3)根据Ka=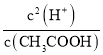 知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要知道氢离子浓度必须测定溶液的pH,要知道醋酸浓度则必须利用酸碱中和滴定的方法测定;
知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要知道氢离子浓度必须测定溶液的pH,要知道醋酸浓度则必须利用酸碱中和滴定的方法测定;
(4) Kh(CN-)=1.61×10-5,则Ka(HCN)=![]() =
=![]() ≈6.2×10-10<1.61×10-5,说明CN-的水解能力强于HCN的电离能力,由于盐与酸的总浓度相等,所以水解产生的c(OH-)大于电离生成的c(H+),混合溶液显碱性;由于水解能力更强,则c(CN-)<c(HCN),因此溶液中各离子浓度由大到小的顺序为:c(Na+)>c(CN-)>c(OH-)>c(H+)。
≈6.2×10-10<1.61×10-5,说明CN-的水解能力强于HCN的电离能力,由于盐与酸的总浓度相等,所以水解产生的c(OH-)大于电离生成的c(H+),混合溶液显碱性;由于水解能力更强,则c(CN-)<c(HCN),因此溶液中各离子浓度由大到小的顺序为:c(Na+)>c(CN-)>c(OH-)>c(H+)。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
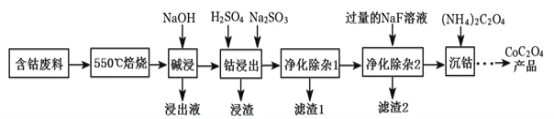
(1)“550℃煅烧”的目的是____。
(2)“浸出液”的主要成分是___。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___。
(4)“净化除杂1”过程中,如何检验该杂质__(用离子方程式表示),现象为__:需在40~50℃加入H2O2溶液,其原因是__,目的是__(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是__。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5 mol/L,则滤液中c(Mg2+)为___mol/L。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
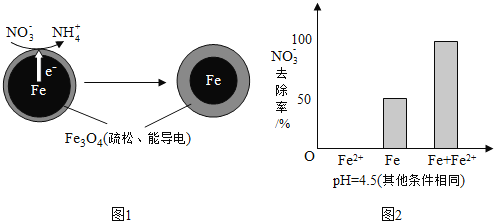
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,同时获得一些副产品,工艺流程如下:
,同时获得一些副产品,工艺流程如下:
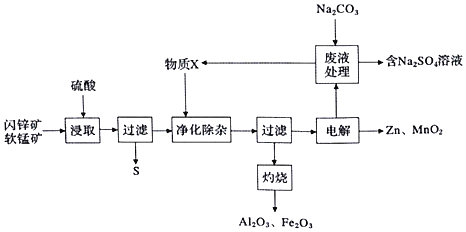
已知:硫酸浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]()
![]() “浸取“时发生的反应中,还原产物为______
“浸取“时发生的反应中,还原产物为______![]() 填化学式
填化学式![]()
![]() “净化除杂”时,加入的物质X可能为______
“净化除杂”时,加入的物质X可能为______![]() 填选项字母
填选项字母![]()
A.![]() B.
B.![]()
![]()
![]()
![]() “电解”时,发生反应的化学方程式为______
“电解”时,发生反应的化学方程式为______
![]() 从
从![]() ,溶液中得到芒硝晶体
,溶液中得到芒硝晶体![]() ,需要进行的实验操作有______、______过滤、洗涤、干燥等
,需要进行的实验操作有______、______过滤、洗涤、干燥等
![]() 和
和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
![]() 已知:
已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() 的pH______
的pH______![]() 填“或“
填“或“![]() ”
”![]() 在废水处理领域中常用
在废水处理领域中常用![]() 将
将![]() 转化为MnS除去,向含有
转化为MnS除去,向含有![]() 废水中通人一定量的
废水中通人一定量的![]() 气体,调节溶液的
气体,调节溶液的![]() ,当
,当![]() 浓度为
浓度为![]() 时,
时,![]() 开始沉淀,则
开始沉淀,则![]() ______。
______。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应并按要求填空。
(1) 铁与氯气在一定条件反应,写出化学反应方程式 _________________其中氧化剂是____________;发生氧化反应的是____________,当1molFe反应时转移_____mol电子
(2)取少量铁与氯气反应得到的固体溶于水,分装在两只试管中,若向其中一支试管滴加KSCN溶液,则溶液变成_____色。向另一支试管滴加NaOH溶液,现象为_________________ 离子反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: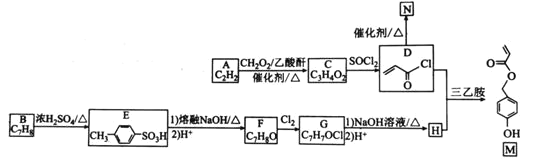
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备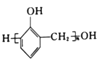 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com