
【题目】某工厂用软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
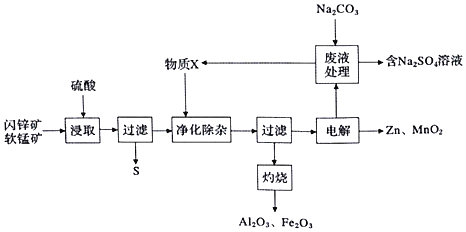
共同生产干电池的原料Zn和![]() ,同时获得一些副产品,工艺流程如下:
,同时获得一些副产品,工艺流程如下:
已知:硫酸浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]()
![]() “浸取“时发生的反应中,还原产物为______
“浸取“时发生的反应中,还原产物为______![]() 填化学式
填化学式![]()
![]() “净化除杂”时,加入的物质X可能为______
“净化除杂”时,加入的物质X可能为______![]() 填选项字母
填选项字母![]()
A.![]() B.
B.![]()
![]()
![]()
![]() “电解”时,发生反应的化学方程式为______
“电解”时,发生反应的化学方程式为______
![]() 从
从![]() ,溶液中得到芒硝晶体
,溶液中得到芒硝晶体![]() ,需要进行的实验操作有______、______过滤、洗涤、干燥等
,需要进行的实验操作有______、______过滤、洗涤、干燥等
![]() 和
和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
![]() 已知:
已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() 的pH______
的pH______![]() 填“或“
填“或“![]() ”
”![]() 在废水处理领域中常用
在废水处理领域中常用![]() 将
将![]() 转化为MnS除去,向含有
转化为MnS除去,向含有![]() 废水中通人一定量的
废水中通人一定量的![]() 气体,调节溶液的
气体,调节溶液的![]() ,当
,当![]() 浓度为
浓度为![]() 时,
时,![]() 开始沉淀,则
开始沉淀,则![]() ______。
______。![]() 已知:
已知:![]()
【答案】![]()
![]()
![]() 蒸发浓缩 冷却结晶 无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等
蒸发浓缩 冷却结晶 无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等 ![]() 5
5
【解析】
软锰矿(主要为MnO2,含杂质Al2O3)和闪锌矿(主要为ZnS,含杂质FcS)共同生产干电池的原料Zn和MnO2,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理时剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
(1)“浸取“时发生的反应中,生成ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3,锰元素化合价+4价变化为+2价被还原得到还原产物;
(2)“净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
(3)“电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液;
(4)溶液中得到溶质固体浓缩蒸发、冷却结晶、过滤洗涤、干燥得到;
(5)反应都需要在高温下进行,因此都需要消耗大量的能量;同时有SO2生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用原理利用率高等;
(6)已知:H2S 的电离常数 K1=1.0×10-7,K2=7.0×l0-15,0.1 mol/L NaHS 的pH比较HS-离子水解常数和电离平衡常数大小判断,当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合此时的pH,以及Ksp=c(Mn2+)c(S2-)进行计算。
软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为
,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() ,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
![]() “浸取“时发生的反应中,生成
“浸取“时发生的反应中,生成![]() 、
、![]() 、
、![]() 、
、![]() ,锰元素化合价
,锰元素化合价![]() 价变化为
价变化为![]() 价被还原得到还原产物为
价被还原得到还原产物为![]() ;
;
![]() “净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
“净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
A.![]() ,可以调节溶液pH且不引入新的杂质,故A符合;
,可以调节溶液pH且不引入新的杂质,故A符合;
B.![]() 可以调节溶液pH且不引入新的杂质,故B符合;
可以调节溶液pH且不引入新的杂质,故B符合;
C.NaOH可以调节溶液pH但引入钠离子,故C不符合;
D.KOH可以调节溶液pH但引入钾离子,故C不符合;
故答案为:AB;
![]() “电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液,反应的化学方程式为:
“电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液,反应的化学方程式为:![]() ;
;
![]() 溶液中得到溶质固体蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
溶液中得到溶质固体蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
![]() 反应都需要在高温下进行,因此都需要消耗大量的能量;同时有
反应都需要在高温下进行,因此都需要消耗大量的能量;同时有![]() 生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用,原料利用率高等,Zn和
生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用,原料利用率高等,Zn和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为:无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等;
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为:无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等;
![]() ,
, ,水解程度大,溶液显碱性,
,水解程度大,溶液显碱性,![]() ,当
,当![]() 时开始沉淀,调节溶液的
时开始沉淀,调节溶液的![]() ,
,![]() 电离常数:
电离常数:![]() ,
,![]() 浓度为
浓度为![]() 时,则
时,则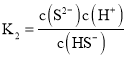 ,则
,则![]() ,则
,则![]() ,所以
,所以![]() ,解得
,解得![]() 。
。
故答案为:![]() ;5。
;5。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应![]() ,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比一定是1:2
C.达到平衡状态时A的物质的量为![]()
D.当![]() 时,可断定反应达到平衡状态
时,可断定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.测定![]() 样品的纯度可用标准
样品的纯度可用标准![]() 溶液进行滴定,取
溶液进行滴定,取![]() 样品溶解酸化后,用
样品溶解酸化后,用![]() 标准
标准![]() 溶液进行滴定,标准
溶液进行滴定,标准![]() 溶液应盛装在________
溶液应盛装在________![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中。实验中,滴定至终点时消耗
滴定管中。实验中,滴定至终点时消耗![]() 溶液
溶液![]() ,则该样品中
,则该样品中![]() 的质量分数是________。
的质量分数是________。![]() 有关离子方程式为:
有关离子方程式为:![]()
Ⅱ.铁矿石中含铁量的测定

(1)步骤![]() 中煮沸的作用是________。
中煮沸的作用是________。
(2)步骤![]() 中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(3)下列有关步骤![]() 的操作中说法正确的是________。
的操作中说法正确的是________。
![]() 因为碘水为黄色,所以滴定过程中不需加指示剂
因为碘水为黄色,所以滴定过程中不需加指示剂
![]() 滴定过程中可利用淀粉溶液作为指示剂
滴定过程中可利用淀粉溶液作为指示剂
![]() 滴定管用蒸馏水洗涤后可以直接装液
滴定管用蒸馏水洗涤后可以直接装液
![]() 锥形瓶不需要用待测液润洗
锥形瓶不需要用待测液润洗
![]() 滴定过程中,眼睛注视滴定管中液面变化
滴定过程中,眼睛注视滴定管中液面变化
![]() 滴定结束后,
滴定结束后,![]() 内溶液不恢复原来的颜色,再读数
内溶液不恢复原来的颜色,再读数
Ⅲ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠![]() ,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:
,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:![]() 溶于水会生成
溶于水会生成![]() 。检验
。检验![]() 晶体在空气中已被氧化的实验方法是________。
晶体在空气中已被氧化的实验方法是________。
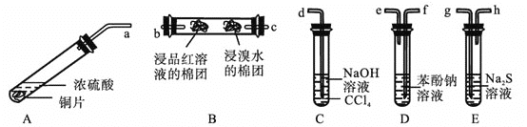
Ⅳ![]() 某化学兴趣小组用铜和浓硫酸制取
某化学兴趣小组用铜和浓硫酸制取![]() ,并依次检验
,并依次检验![]() 具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示
具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示![]() 图中连接胶管、夹持和加热装置省略
图中连接胶管、夹持和加热装置省略![]() :
:
查阅资料可知:![]() 的酸性强弱与
的酸性强弱与![]() 相近。
相近。
上述装置的接口连接顺序依次是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 填导管接口字母
填导管接口字母![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
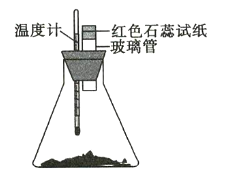
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=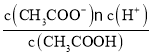 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=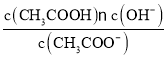 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
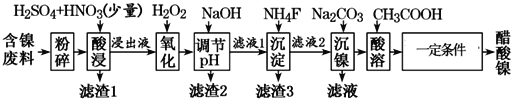
T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:

已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列问题:
(1)“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
(2)“分铜渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
(4)从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
(5)向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
(6)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知![]() =2.25)。
=2.25)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com