
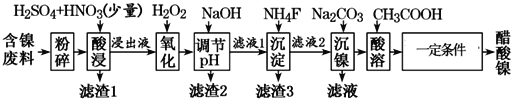
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。
【答案】加快反应速度,提高镍的浸出率 5.0≤pH<6.7 SiO2 CaF2 2Fe2++H2O2+2H+=2Fe3++2H2O NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O 31.8 蒸发浓缩 冷却结晶
【解析】
制取醋酸镍的工艺流程为:含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,NiS、Al2O3、FeO、CaO会发生反应,NiS、Al2O3、FeO产生相应的盐进入溶液,SiO2不能反应,CaO反应后转化为微溶于水的CaSO4,所以反应后过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把溶液中的Fe2+氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,所以滤渣2为Al(OH)3、Fe(OH)3,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,向溶液中加入NH4F,溶液中的Ca2+与F-会发生反应产生CaF2沉淀,过滤,滤渣3为CaF2,向滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)“酸浸”前将废料粉碎,其目的是可增大固体接触面积,从而提高了镍的浸出率。
(2)H2O2把溶液中的Fe2+氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,所以滤渣2为Al(OH)3、Fe(OH)3,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7。
(3)根据上述分析可知滤渣1主要成分的化学式是CaSO4和SiO2,向含有Ni2+的滤液中加入NH4F,溶液中的Ca2+与F-会发生反应产生CaF2沉淀,所以滤渣3主要成分的化学式CaF2。
(4)在氧化步骤中,加入H2O2,可以发生氧化还原反应,把Fe2+氧化为Fe3+,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O。
(5)在用H2SO4、HNO3进行酸浸过程中,1 mol NiS失去6NA个电子,被氧化产生NiSO4,同时得到SO2、NO两种无色有毒气体。该反应化学方程式:NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O。
(6)已知NiCO3的Ksp=1.0×10-5,使100ml该滤液中的Ni2+沉淀物完全,则c(Ni2+)≤10-5mol/L,溶液中c(CO32-)=![]() mol/L=1.0mol/L,与Ni2+反应的n(CO32-)=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量:n(CO32-)=0.2mol+1.0mol/L×0.1L=0.3mol,所以需要加入Na2CO3固体的质量最少m(Na2CO3)=0.3mol×106g/mol=31.8g;
mol/L=1.0mol/L,与Ni2+反应的n(CO32-)=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量:n(CO32-)=0.2mol+1.0mol/L×0.1L=0.3mol,所以需要加入Na2CO3固体的质量最少m(Na2CO3)=0.3mol×106g/mol=31.8g;
(7)加入醋酸进行酸溶得到醋酸镍溶液,将该溶液蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥得到醋酸镍产品。


科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.等质量的CH4和CO2产生的温室效应是后者大
B.达到最强烈爆炸点时,CH4与O2的体积之比等于1:3
C.甲烷与氯气发生取代反应,其氯代产物与HCl分离可采用水洗法
D.甲烷为正四面体结构而不是平面四边形结构的事实是:CHCl3只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,同时获得一些副产品,工艺流程如下:
,同时获得一些副产品,工艺流程如下:
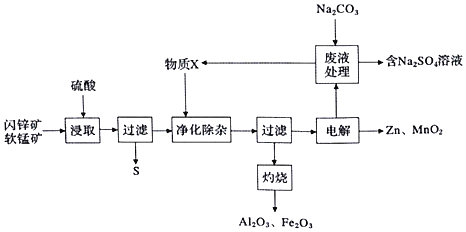
已知:硫酸浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]()
![]() “浸取“时发生的反应中,还原产物为______
“浸取“时发生的反应中,还原产物为______![]() 填化学式
填化学式![]()
![]() “净化除杂”时,加入的物质X可能为______
“净化除杂”时,加入的物质X可能为______![]() 填选项字母
填选项字母![]()
A.![]() B.
B.![]()
![]()
![]()
![]() “电解”时,发生反应的化学方程式为______
“电解”时,发生反应的化学方程式为______
![]() 从
从![]() ,溶液中得到芒硝晶体
,溶液中得到芒硝晶体![]() ,需要进行的实验操作有______、______过滤、洗涤、干燥等
,需要进行的实验操作有______、______过滤、洗涤、干燥等
![]() 和
和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
![]() 已知:
已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() 的pH______
的pH______![]() 填“或“
填“或“![]() ”
”![]() 在废水处理领域中常用
在废水处理领域中常用![]() 将
将![]() 转化为MnS除去,向含有
转化为MnS除去,向含有![]() 废水中通人一定量的
废水中通人一定量的![]() 气体,调节溶液的
气体,调节溶液的![]() ,当
,当![]() 浓度为
浓度为![]() 时,
时,![]() 开始沉淀,则
开始沉淀,则![]() ______。
______。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应并按要求填空。
(1) 铁与氯气在一定条件反应,写出化学反应方程式 _________________其中氧化剂是____________;发生氧化反应的是____________,当1molFe反应时转移_____mol电子
(2)取少量铁与氯气反应得到的固体溶于水,分装在两只试管中,若向其中一支试管滴加KSCN溶液,则溶液变成_____色。向另一支试管滴加NaOH溶液,现象为_________________ 离子反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
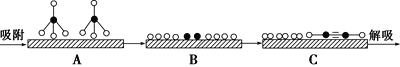
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用![]() 和
和![]() 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
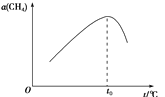
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0 ℃后CH4的转化率突减的原因可能是_______。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
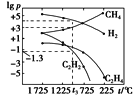
①t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图中,t3 ℃时,化学反应2CH4(g)![]() C2H2(g)+3H2(g)的压强平衡常数Kp=____。
C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
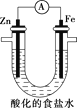
操作 | 现象 |
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
(ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
得出结论:①锌______保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如下:

回答下列问题:
(1)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式____________。
(2)在溶液I中加入NaOH固体的目的是_______(填字母)。
A.与反应液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图1为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4的生成率的影响。

工业生产中最佳温度为_______,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为_____。
(4)反应③中的离子反应方程式为_________________;溶液Ⅱ中加入饱和KOH得到湿产品的原因是__________________。
(5)高铁酸钾作为水处理剂是能与水反应其离子反应是:4FeO42-+l0H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①_______________;②_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com