
【题目】分析下列反应并按要求填空。
(1) 铁与氯气在一定条件反应,写出化学反应方程式 _________________其中氧化剂是____________;发生氧化反应的是____________,当1molFe反应时转移_____mol电子
(2)取少量铁与氯气反应得到的固体溶于水,分装在两只试管中,若向其中一支试管滴加KSCN溶液,则溶液变成_____色。向另一支试管滴加NaOH溶液,现象为_________________ 离子反应的方程式为______________________。
【答案】2Fe+3Cl2![]() 2FeCl3 Cl2 Fe 3 红 产生红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
2FeCl3 Cl2 Fe 3 红 产生红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
【解析】
从电子转移角度分析氧化还原反应概念间的关系;应用铁离子的性质分析实验现象。
(1)点燃或加热时,铁与氯气发生反应2Fe+3Cl2![]() 2FeCl3。其中氯从0价变成-1价,Cl2是氧化剂;铁从0价变成+2价,失电子发生氧化反应。当1molFe反应时转移3mol电子。
2FeCl3。其中氯从0价变成-1价,Cl2是氧化剂;铁从0价变成+2价,失电子发生氧化反应。当1molFe反应时转移3mol电子。
(2)少量FeCl3固体溶于水,所得溶液中滴加KSCN溶液,则发生反应Fe3++3SCN-=Fe(SCN)3,使溶液变成红色。所得溶液中滴加NaOH溶液,发生反应Fe3++3OH-=Fe(OH)3↓,故有红褐色沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
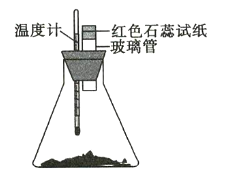
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=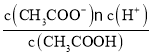 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=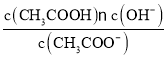 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,1molX和3mol Y进行反应:X(g)+3Y(g)![]() 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.125mol/(L·s)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的![]()
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的ΔH<0,升高温度,平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
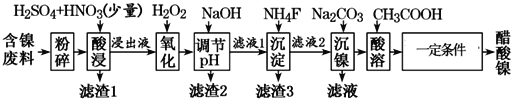
T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
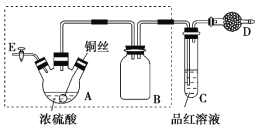
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________。
(2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。
(3)装置A中发生反应的化学方程式为____________________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物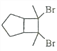 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com