
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
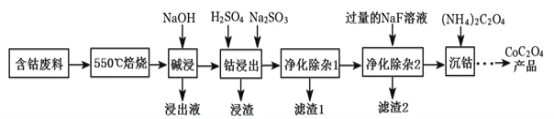
(1)“550℃煅烧”的目的是____。
(2)“浸出液”的主要成分是___。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___。
(4)“净化除杂1”过程中,如何检验该杂质__(用离子方程式表示),现象为__:需在40~50℃加入H2O2溶液,其原因是__,目的是__(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是__。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5 mol/L,则滤液中c(Mg2+)为___mol/L。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
【答案】除去碳和有机物 Na AlO2 2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ 有蓝色沉淀产生 H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解 3Fe2++2H++H2O2=3Fe3++2H2O Fe(OH)3 7.0×10-6
+2H+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ 有蓝色沉淀产生 H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解 3Fe2++2H++H2O2=3Fe3++2H2O Fe(OH)3 7.0×10-6
【解析】
550℃焙烧含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)除去碳和有机物,加入氢氧化钠溶液,其中Al2O3溶解生成Na AlO2,Co2O3、Fe2O3、MgO不溶,过滤,CaO与水反应生成氢氧化钙,则浸出液的主要为Na AlO2,向过滤得到的固体加入稀硫酸和亚硫酸钠,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,可得CoCl2、FeCl2、MgCl2、CaCl2,在40~50℃加入H2O2,氧化Fe2+氧化为Fe3+,再升温至80~85℃,加入Na2CO3调pH至5,可得到Fe(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,滤液中主要含有CoCl2,加入草酸铵溶液得到草酸钴。
(1)碳和有机物可通过焙烧除去,含钴废料“550℃焙烧”可以除去碳和有机物,故答案为:除去碳和有机物;
(2)550℃焙烧含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)除去碳和有机物,加入氢氧化钠溶液,Al2O3溶解,氧化铝可以和氢氧化钠溶液之间反应生成偏铝酸钠:Al2O3+2 NaOH=2 NaAlO2+H2O,CaO与水反应生成氢氧化钙,所以浸出液的主要成分为Na AlO2(Na AlO2和NaOH、Ca(OH)2);故答案为:Na AlO2;
(3)“钴浸出”过程中Co3+转化为Co2+,则Na2SO3将Co3+还原为Co2+,自身被氧化为硫酸钠,发生的反应为:2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+;故答案为:2Co3++SO
+2H+;故答案为:2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+;
+2H+;
(4)“净化除杂1”过程中,向过滤得到的固体加入稀硫酸和亚硫酸钠,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,用K3[Fe(CN)6]检验Fe2+:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,现象为有蓝色沉淀产生:需在40~0℃加入H2O2溶液,其原因是H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解,目的是氧化Fe2+氧化为Fe3+,3Fe2++2H++H2O2=3Fe3++2H2O;再升温至80~85℃,加入Na2CO3溶液,调pH至5,铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO![]() +3H2O=2Fe(OH)3↓+3CO2↑,“滤渣I”的主要成分是Fe(OH)3。故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;有蓝色沉淀产生;H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解;3Fe2++2H++H2O2=3Fe3++2H2O;Fe(OH)3;
+3H2O=2Fe(OH)3↓+3CO2↑,“滤渣I”的主要成分是Fe(OH)3。故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;有蓝色沉淀产生;H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解;3Fe2++2H++H2O2=3Fe3++2H2O;Fe(OH)3;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积计算,c(Mg2+):c(Ca2+)=Ksp(MgF2):Ksp(CaF2)=7.35×10-11:1.05×10-10=0.7,若所得滤液中c(Ca2+)=1.0×10-5 mol·L-1,则滤液中c(Mg2+)=7.0×10-6mol·L-1,故答案为:7.0×10-6 mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为![]() NA
NA
C.12g石墨中含有3NA个C-C共价键
D.常温常压下有28g单晶硅晶体,则其中所含的Si﹣Si键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(227℃,1个大气压时),1.5L某烃蒸汽能在aL氧气中完全燃烧,体积增大到(a+3)L(相同条件下),问:
(1)该烃在组成上必须满足的基本条件是____________________
(2)当a=10L时,该烃可能的分子式__________________
(3)当该烃的分子式为C7H8时,a的取值范围为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应![]() ,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比一定是1:2
C.达到平衡状态时A的物质的量为![]()
D.当![]() 时,可断定反应达到平衡状态
时,可断定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工农业生产中有着广泛应用,回答下列问题:
![]() 基态镍原子的价电子排布式为_________;元素镍的第二电离能比铜的小,其原因为_________________。
基态镍原子的价电子排布式为_________;元素镍的第二电离能比铜的小,其原因为_________________。
![]() 的检验可通过如下反应进行:
的检验可通过如下反应进行:
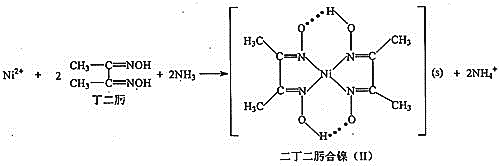
![]() 丁二肟中碳原子的杂化轨道类型为___________。
丁二肟中碳原子的杂化轨道类型为___________。
![]() 二丁二肟合镍
二丁二肟合镍![]() Ⅱ
Ⅱ![]() 中存在的作用力有_________
中存在的作用力有_________![]() 填选项字母
填选项字母![]() 。
。
A.![]() 键
键 ![]() 键
键 ![]() 配位健
配位健 ![]() 氢键
氢键
![]() 四羰基镍
四羰基镍![]() 为无色挥发性剧毒液体。熔点
为无色挥发性剧毒液体。熔点![]() ,沸点
,沸点![]() 。不溶于水,易溶于乙醇等有机溶剂,呈四面体构型。四羰基镍的晶体类型是__________。
。不溶于水,易溶于乙醇等有机溶剂,呈四面体构型。四羰基镍的晶体类型是__________。![]() 可通过如下反应合成:
可通过如下反应合成:![]() 。反应中涉及所有元素的电负性由大到小的顺序为______________:与
。反应中涉及所有元素的电负性由大到小的顺序为______________:与![]() 互为等电子体的分子有__________
互为等电子体的分子有__________![]() 任写1种
任写1种![]() 。
。
![]() 和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
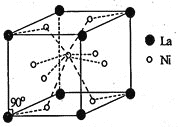
![]() 该晶体的化学式为____________。
该晶体的化学式为____________。
![]() 已知该晶体的摩尔质量为
已知该晶体的摩尔质量为![]() ,密度为
,密度为![]() 。设
。设![]() 为阿伏加德罗常数的值,则该晶胞的体积是___________
为阿伏加德罗常数的值,则该晶胞的体积是___________![]() 用含M、d、
用含M、d、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。
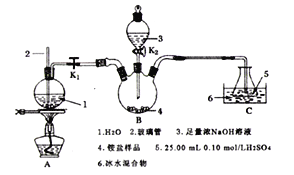
回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________。
(2)盛放氢氧化钠溶液的仪器名称为__________________;玻璃管2的作用是___________________;圆底烧瓶中碎瓷片的作用是_________________________________________。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________。
②C装置冰水混合物的作用是__________________________________。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=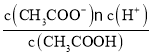 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=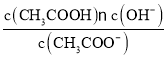 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com