
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
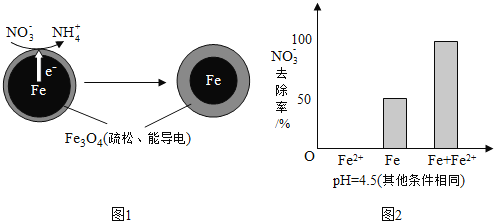
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
【答案】铁 ![]()
![]() 不导电,阻碍电子转移 本实验条件下,
不导电,阻碍电子转移 本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率
的去除率 ![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移 初始pH低时,产生的
,利于电子转移 初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足
不足
【解析】
(1)NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;(2)pH越高Fe3+越易水解生成FeO(OH);
(3)①根据图2中的三个实验结果进行分析;
②结合(2)题中的铁的最终物质形态结果差异进行分析;
(1) ①Fe还原水体中![]() ,则Fe作还原剂发生氧化反应,失去电子,作负极,
,则Fe作还原剂发生氧化反应,失去电子,作负极,
故答案为:铁;
![]() 在正极得电子发生还原反应产生
在正极得电子发生还原反应产生![]() ,根据图2信息可知为酸性环境,则正极的电极反应式为:
,根据图2信息可知为酸性环境,则正极的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①加入![]() 可以显提高
可以显提高![]() 的去除率,pH越高,
的去除率,pH越高,![]() 越易水解生成
越易水解生成![]() ,而
,而![]() 不导电,阻碍电子转移,所以
不导电,阻碍电子转移,所以![]() 的去除率低,故答案为:
的去除率低,故答案为:![]() 不导电,阻碍电子转移;
不导电,阻碍电子转移;
(3)从图2的实验结果可以看出,单独加入![]() 时,
时,![]() 的去除率为0,因此得出
的去除率为0,因此得出![]() 不能直接还原
不能直接还原![]() ;而Fe和
;而Fe和![]() 共同加入时
共同加入时![]() 的去除率比单独Fe高,因此可以得出结论:本实验条件下,
的去除率比单独Fe高,因此可以得出结论:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率,故答案为:本实验条件下,
的去除率,故答案为:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率;
的去除率;
![]() 同位素示踪法证实了
同位素示踪法证实了![]() 能与
能与![]() 反应生成
反应生成![]() ,离子方程式为:
,离子方程式为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移,故答案为:
,利于电子转移,故答案为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移;
,利于电子转移;
(4)根据实验结果可知![]() 的作用是将不导电的
的作用是将不导电的![]() 转化为可导电的
转化为可导电的![]() ,而
,而![]() 的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响
的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响![]() 的含量,故答案为:初始pH低时,产生的
的含量,故答案为:初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足。
不足。


科目:高中化学 来源: 题型:
【题目】(227℃,1个大气压时),1.5L某烃蒸汽能在aL氧气中完全燃烧,体积增大到(a+3)L(相同条件下),问:
(1)该烃在组成上必须满足的基本条件是____________________
(2)当a=10L时,该烃可能的分子式__________________
(3)当该烃的分子式为C7H8时,a的取值范围为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。
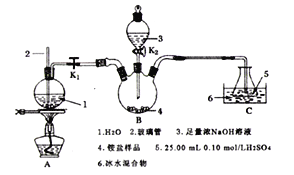
回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________。
(2)盛放氢氧化钠溶液的仪器名称为__________________;玻璃管2的作用是___________________;圆底烧瓶中碎瓷片的作用是_________________________________________。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________。
②C装置冰水混合物的作用是__________________________________。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将少量铝粉加入某溶液中,有氢气放出,则该溶液中一定能够大量共存的离子组是:( )
A.K+、Na+、![]() 、Cl-B.
、Cl-B.![]() 、Al3+、Cl-、
、Al3+、Cl-、![]()
C.K+、Na+、[Al(OH)4]-、![]() -D.Na+、K+、
-D.Na+、K+、![]() 、Br-
、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.测定![]() 样品的纯度可用标准
样品的纯度可用标准![]() 溶液进行滴定,取
溶液进行滴定,取![]() 样品溶解酸化后,用
样品溶解酸化后,用![]() 标准
标准![]() 溶液进行滴定,标准
溶液进行滴定,标准![]() 溶液应盛装在________
溶液应盛装在________![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中。实验中,滴定至终点时消耗
滴定管中。实验中,滴定至终点时消耗![]() 溶液
溶液![]() ,则该样品中
,则该样品中![]() 的质量分数是________。
的质量分数是________。![]() 有关离子方程式为:
有关离子方程式为:![]()
Ⅱ.铁矿石中含铁量的测定

(1)步骤![]() 中煮沸的作用是________。
中煮沸的作用是________。
(2)步骤![]() 中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(3)下列有关步骤![]() 的操作中说法正确的是________。
的操作中说法正确的是________。
![]() 因为碘水为黄色,所以滴定过程中不需加指示剂
因为碘水为黄色,所以滴定过程中不需加指示剂
![]() 滴定过程中可利用淀粉溶液作为指示剂
滴定过程中可利用淀粉溶液作为指示剂
![]() 滴定管用蒸馏水洗涤后可以直接装液
滴定管用蒸馏水洗涤后可以直接装液
![]() 锥形瓶不需要用待测液润洗
锥形瓶不需要用待测液润洗
![]() 滴定过程中,眼睛注视滴定管中液面变化
滴定过程中,眼睛注视滴定管中液面变化
![]() 滴定结束后,
滴定结束后,![]() 内溶液不恢复原来的颜色,再读数
内溶液不恢复原来的颜色,再读数
Ⅲ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠![]() ,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:
,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:![]() 溶于水会生成
溶于水会生成![]() 。检验
。检验![]() 晶体在空气中已被氧化的实验方法是________。
晶体在空气中已被氧化的实验方法是________。
Ⅳ![]() 某化学兴趣小组用铜和浓硫酸制取
某化学兴趣小组用铜和浓硫酸制取![]() ,并依次检验
,并依次检验![]() 具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示
具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示![]() 图中连接胶管、夹持和加热装置省略
图中连接胶管、夹持和加热装置省略![]() :
:
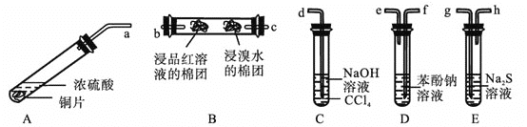
查阅资料可知:![]() 的酸性强弱与
的酸性强弱与![]() 相近。
相近。
上述装置的接口连接顺序依次是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 填导管接口字母
填导管接口字母![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3COOH![]() CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=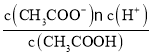 ;CH3COO-+H2O
;CH3COO-+H2O![]() CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=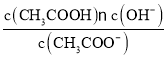 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解平衡常数Kh以及水的离子积常数KW的关系是____________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=______(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②____________;③用______________(填一种实验方法)测定溶液浓度c′。
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显__________(填“酸”、“碱”或“中”)性,c(CN-)________(填“>”、“<”或“=”)c(HCN)。该溶液中各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,水的离子积常数KW=1.0×10-12,请回答下列问题:
(1)此温度___25℃(填“>”、“<”或“=”),原因是___。
(2)对水进行下列操作,能抑制水的电离的是___。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)=__。
(4)醋酸的下列性质中,可以证明它是弱电解质的是___。
①1mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL1mol/L的CH3COOH恰好与10mL1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO-、H+同时存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com