
| 6.5g |
| 65g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| A、氢氧化钠的摩尔质量是40g |
| B、“物质的量浓度”可简称为“量浓度” |
| C、阿伏加德罗常数的单位是mol-1 |
| D、1mol任何物质所占体积都是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A、不溶于水 |
| B、属于芳香族化合物 |
| C、在加热和催化剂作用下,最多能和4mol H2反应 |
| D、既能发生氧化反应也能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
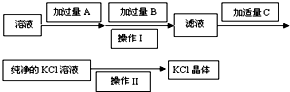 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
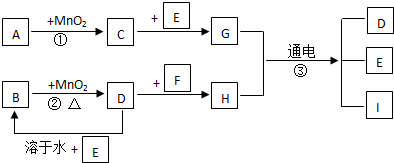
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com