
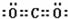 ;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为
;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为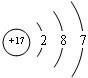 ;Z是N元素,氮元素氢化物的结构式为
;Z是N元素,氮元素氢化物的结构式为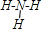 ;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,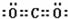 ;
; ;
;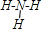 ;第三周期第VIA族;离子键和共价键;
;第三周期第VIA族;离子键和共价键;

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
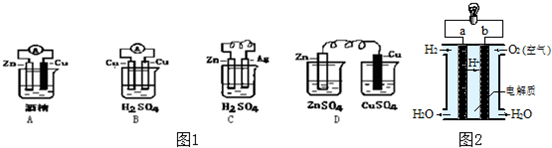
 将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.
将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:
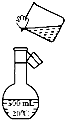 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05mol/(L?s) |
| B、0.05mol/L |
| C、0.033 mol/(L?s) |
| D、0.075 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO4_2-=BaSO4↓+2H2O |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、次氯酸钠溶液中通入SO2气体:2ClO-+SO2+H2O═2HClO+SO42- |
| D、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com