
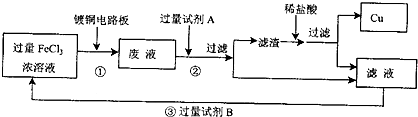
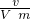 =
=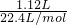 =0.05mol,再由方程式:Fe+2H+=Fe2++H2↑,可求得n(Fe)=0.05mol,则m(Fe)=n?M=2.8g,故m(Cu)=7.2g,所以则滤渣中Cu的质量分数=
=0.05mol,再由方程式:Fe+2H+=Fe2++H2↑,可求得n(Fe)=0.05mol,则m(Fe)=n?M=2.8g,故m(Cu)=7.2g,所以则滤渣中Cu的质量分数=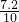 ×100%=72%,故答案为72%.
×100%=72%,故答案为72%.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
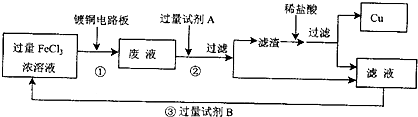
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑦ | B、①③④⑥ | C、②④⑥⑦ | D、①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:013
电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
A.①②④⑦ B.①③④⑥ C.②④⑥⑦ D.①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
A.①②④⑦ B.①③④⑥
C.②④⑥⑦ D.①④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com