
| v |
| V m |
| 1.12L |
| 22.4L/mol |
| 7.2 |
| 10 |


科目:高中化学 来源: 题型:
| A、①②④⑦ | B、①③④⑥ | C、②④⑥⑦ | D、①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.①②④⑦ B.①③④⑥ C.②④⑥⑦ D.①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
A.①②④⑦ B.①③④⑥
C.②④⑥⑦ D.①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
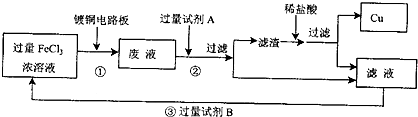
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com