
����Ŀ��X��Y��Z��W��M��NΪԭ������������������ֶ�����Ԫ�أ������£�����Ԫ�صij�������������Ϊ���壬����Ϊ���塣X��M��W��N�ֱ�ͬ���壬�����ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���X����Y��Z��W�ֱ��γɵ�������ȵ����ַ��ӣ�Z��W������������֮����M�ĺ������������ȡ��Իش��������⣺
![]() ��Z��W��N����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С������˳���� ______
��Z��W��N����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С������˳���� ______ ![]() ��Ԫ�ط��ű�ʾ
��Ԫ�ط��ű�ʾ![]() ��
��
![]() ��X��Z��W��N����Ԫ���е�����Ԫ�ؿ����һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ����÷�Ӧ�Ļ�ѧ����ʽΪ ______ ��
��X��Z��W��N����Ԫ���е�����Ԫ�ؿ����һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ����÷�Ӧ�Ļ�ѧ����ʽΪ ______ ��
![]() ��X��Z��W��N����Ԫ����ɵ�һ�����ӻ�����A����֪A���������ᷴӦ����������ˮ��Ӧ��д��A���������ᷴӦ�����ӷ���ʽ ______ ��
��X��Z��W��N����Ԫ����ɵ�һ�����ӻ�����A����֪A���������ᷴӦ����������ˮ��Ӧ��д��A���������ᷴӦ�����ӷ���ʽ ______ ��
![]() ��X��Z��W��N��Fe����Ԫ�ؿ�������������Ļ�����
��X��Z��W��N��Fe����Ԫ�ؿ�������������Ļ�����![]() ��Է�������Ϊ
��Է�������Ϊ![]() ��1molH�к���6mol�ᾧˮ���Ի�����H��������ʵ�飺
��1molH�к���6mol�ᾧˮ���Ի�����H��������ʵ�飺
![]() ȡH����Һ�����������NaOHŨ��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����塣��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
ȡH����Һ�����������NaOHŨ��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����塣��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
![]() ��ȡH����Һ�����������
��ȡH����Һ�����������![]() ��Һ������ɫ������������������ܽ⡣
��Һ������ɫ������������������ܽ⡣
![]() �Ļ�ѧʽΪ ______ ��
�Ļ�ѧʽΪ ______ ��
![]() ��֪100mL
��֪100mL![]() ��H��Һ����20mL
��H��Һ����20mL![]()
![]() ��Һ
��Һ![]() �����ữ
�����ữ![]() ǡ�÷�Ӧ��д���÷�Ӧ�����ӷ���ʽ______��
ǡ�÷�Ӧ��д���÷�Ӧ�����ӷ���ʽ______��
���𰸡�![]()
![]() ϡ
ϡ![]()
![]() ��
��![]()
![]()
![]()
��������
X��Y��Z��W��M��NΪԭ������������������ֶ�����Ԫ�أ������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���XΪ��Ԫ�أ�X��Mͬ���壬���ԭ��������֪MΪNa��Y��Z��W��ԭ������С��M�����ڵڶ����ڣ�X����Y��Z��W�ֱ��γɵ�������ȵ����ַ��ӣ�����10���ӷ��ӣ�Z��W������������֮����M�ĺ������������ȣ���ƽ������������Ϊ![]() ��Z����������Ϊ5��W����������Ϊ6������֪YΪC��ZΪN��WΪO��W��N�ֱ�ͬ���壬��NΪSԪ�ء�
��Z����������Ϊ5��W����������Ϊ6������֪YΪC��ZΪN��WΪO��W��N�ֱ�ͬ���壬��NΪSԪ�ء�
![]() ͬ�����������ԭ�Ӱ뾶��С�����Ӳ�Խ��ԭ�Ӱ뾶Խ��ԭ�Ӱ뾶
ͬ�����������ԭ�Ӱ뾶��С�����Ӳ�Խ��ԭ�Ӱ뾶Խ��ԭ�Ӱ뾶![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ��H��N��O��S����Ԫ���е�����Ԫ�ؿ����һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ��Ӧ��Cu��ϡ���ᷴӦ��������ͭ��NO��ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��
��H��N��O��S����Ԫ���е�����Ԫ�ؿ����һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ��Ӧ��Cu��ϡ���ᷴӦ��������ͭ��NO��ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ϡ
ϡ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ϡ
ϡ![]() ��
��
![]() ��H��N��O��S����Ԫ����ɵ�һ�����ӻ�����A��A���������ᷴӦ����������ˮ��Ӧ����AΪ
��H��N��O��S����Ԫ����ɵ�һ�����ӻ�����A��A���������ᷴӦ����������ˮ��Ӧ����AΪ![]() ��
��![]() ��A���������ᷴӦ�����ӷ���ʽΪ��
��A���������ᷴӦ�����ӷ���ʽΪ��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ��H��N��O��S��Fe����Ԫ����ɵ���Է�������Ϊ392�Ļ�����C��1molC�к���6mol�ᾧˮ����C����Һ�м������ŨNaOH��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����壬��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��˵��C�к���
��H��N��O��S��Fe����Ԫ����ɵ���Է�������Ϊ392�Ļ�����C��1molC�к���6mol�ᾧˮ����C����Һ�м������ŨNaOH��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����壬��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��˵��C�к���![]() ��
��![]() ����ȡ����C����Һ�������м������
����ȡ����C����Һ�������м������![]() ��Һʱ������ɫ�������ټ���ϡ����������ܽ⣬˵��C�к���
��Һʱ������ɫ�������ټ���ϡ����������ܽ⣬˵��C�к���![]() ��
��![]() ���C����Է��������ͽᾧˮ������֪C�Ļ�ѧʽΪ
���C����Է��������ͽᾧˮ������֪C�Ļ�ѧʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��Һ
��Һ![]() �����ữ
�����ữ![]() ��Ӧ���ӷ���ʽΪ��
��Ӧ���ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]()



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ͨ�����������壨Fe3O4/FeO)��Ȼ�ԭ���������ϳɶ����ѣ�CH3OCH3) ��ԭ����ͼ��
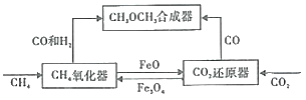
��1��CH4�������з���������Ӧ��
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850��ʱ��ѹǿ�Ͳ���������������������������������Ĺ�ϵ��ͼ��
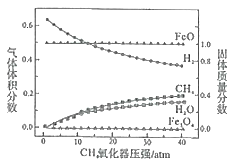
������ѹǿ������Ӧi��ƽ�ⳣ��Kֵ___(����������������С������������)��
�ڽ��ͼ����H2O����������仯��ԭ��___(�û�ѧ����ʽ��ʾ����
��2����һ������FeO��CO2����CO2��ԭ�������������ܱ��������У�����������Ӧ��CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)�����������������䣬��ò�ͬ�¶������շ�Ӧ��ϵ��CO��CO2������������
�¶�t/�� | 100 | 170 | 200 | 300 | 400 | 500 |
CO2������� | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO������� | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
�١�H2___0(����������������)��
�����ϱ���֪������150��ʱ��������ת��������ת������(FeO)Ϊ100%����������Ӧ��ϵ�У�һ������˵���÷�Ӧ�ﵽƽ��״̬����___(���ţ���
A.CO2�����ʵ������� B.��ϵ��ѹǿ����
C.�����ƽ��Ħ���������� D.CO���������ʺ�������������Ҳ�������
�۸��ݻ�ѧ��Ӧԭ��������CO2��ԭ���¶�������170���ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ��
(1)AlCl3ˮ����Һ�����ԡ�________
(2)��TiCl4������ˮ������TiO2��xH2O��________
(3)NaHCO3��ˮ��Һ�еĵ��뷽��ʽ��__________
(4)��Mg(OH)2����Һ�м���NH4Cl��Һ�������ܽ⡣___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ð�������![]() ��
��![]() �Ǵ�����Ⱦ�����о����ȵ㣬�����������漰�ķ�ӦΪ��
�Ǵ�����Ⱦ�����о����ȵ㣬�����������漰�ķ�ӦΪ��
����Ӧ��![]()
����Ӧ��
��4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H=-905.5KJ/mol
��4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ��H=-1104.9KJ/mol
��4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=-1269.0KJ/mol
�ش��������⣺
��1������Ӧ�ġ�HΪ______
��2����ͼ��ʾ����������������ͬ��ʹ�����ֲ�ͬ�Ĵ���������ӦNO��ת�������¶ȹ�ϵ��ͼ��ʾ��
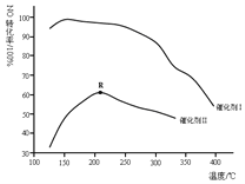
��ѡ�ô���I��������______![]() д��һ��
д��һ��![]()
��R���Ӧ���¶�Ϊ2100C������2100C��NO��ת�����Dz��Ƕ�Ӧ�¶��µ�ƽ��ת���ʣ��������жϲ�д������______��
��3�������£���ͨ����������������![]() ��NaOH��Һ����NOҲ��ʵ������
��NaOH��Һ����NOҲ��ʵ������![]() ������ҪΪ
������ҪΪ![]() ��
��![]() ����֪��Ӧ����Һ��
����֪��Ӧ����Һ��![]() ����Һ��
����Һ��![]() Ũ��Ϊ5.6��10-2mol/L�����Է�Ӧ��������Һ����仯��
Ũ��Ϊ5.6��10-2mol/L�����Է�Ӧ��������Һ����仯��![]() �ĵ���ƽ�ⳣ��Ϊ5.1��10-4����
�ĵ���ƽ�ⳣ��Ϊ5.1��10-4����
��c(NO2-)c(OH-)/c(HNO2)=______![]()
��ij��Һ��c(NO2-)=1.0��10-6mol/L��ȡ����Һ5mL������һ��![]() ����������Һ
����������Һ![]() һ��Ϊ
һ��Ϊ![]() ��ͨ������˵���ܷ��������______[Ksp(AgNO2)=2��10-8]
��ͨ������˵���ܷ��������______[Ksp(AgNO2)=2��10-8]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ���������ֵ������˵������ȷ����
A.���³�ѹ�£�2 g��������ԭ����ĿΪ2NA
B.1 mol NH4+���еĵ�����Ϊ10 NA
C.һ����������ˮ������Ӧ����1 g��������Ӧ��ת�Ƶĵ�����ΪNA
D.��״���£�0.3 mol NO2ͨ������ˮ����ȫ��Ӧ�������������ԼΪ4.48 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����
A.pH=4�Ĵ����У�c��H+��= 0.4mol��L-1
B.����̼��������Һ�У���֪̼��������Һ�ʼ��ԣ���c��Na+��= c��HCO3-��
C.����ʳ��ˮ�У�c��Na+��+ c��H+��= c��Cl-��+c��OH-��
D.pH=12�Ĵ�����Һ�У�c��OH-��=1.0��10-12mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����dz��õĻ�ѧ��Դ����缫���Ϸֱ���Pb��PbO2�����ҺΪϡ���ᡣ�ŵ�ʱ���õ���ܷ�ӦʽΪ��Pb��PbO2��2H2SO4 ![]() 2PbSO4��2H2O���������������жϣ�
2PbSO4��2H2O���������������жϣ�
��1�������صĸ���������_________���ŵ�ʱ����_________������������������ԭ������Ӧ��
��2�������طŵ�ʱ���������Һ������_________������������������С����������������
��3����֪����ǦΪ������ˮ�İ�ɫ���壬����ʱ�����ڵ缫�ϡ���д���õ�طŵ�ʱ�������ĵ缫��Ӧ_______________________________________�������ӷ���ʽ��ʾ����
��4������ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㣬�������ܶȸ���Ǧ���ء��������ΪH2SO4��Һ��������ȼ�ϵ�ص�������ӦʽΪ__________________________________��
��5��Ǧ�ĵ�⾫���ǹ�ҵ��ʵ�ַ�Ǧ�����Լ���Ǧ�ᴿ����Ҫ�ֶΡ�Ǧ�ĵ�⾫������PbSiF6��H2SiF6����ǿ�������ɵ�ˮ��Һ�н��С��ӻ�ԭ¯�в�����ij��Ǧ�ɷ����±���ʾ��
�ɷ� | Pb | Cu | Ag | Fe | Zn | Sn | ���� |
�� | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
����⾫��ʱ���������Ҫ�ɷ���______��Ԫ�ط��ţ���
���������У���Ǧ���������SiF6���壬д���õ缫��Ӧʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������й㷺����;���о����֣�������������ṹΪ����![]() ��
��![]() �ṩ����Ǩ�ƵĿ���ͨ������������ȱ����������ʹ����е���DZ�������磺ͼ
�ṩ����Ǩ�ƵĿ���ͨ������������ȱ����������ʹ����е���DZ�������磺ͼ![]() ��ʾ��﮳����ӵ���
��ʾ��﮳����ӵ���![]() ��ͼ
��ͼ![]() ��ʾ��������ȱ������NaCl��
��ʾ��������ȱ������NaCl��
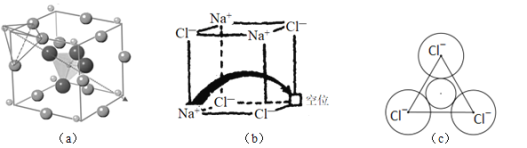
������ѧ֪ʶ�ش��������⣺
��1���ڱ仯��Cl+e-��Cl-�������У����õ�������ڻ�̬Cl��________�ܼ����˹��̻�_______![]() ���������������ͷ���
���������������ͷ���![]() ������
������
��2��![]() ��B���ӻ���ʽΪ__________����ȵ�����Ϊ��___________
��B���ӻ���ʽΪ__________����ȵ�����Ϊ��___________![]() ��дһ��
��дһ��![]() ������VSEPRģ����ͬ������1�Թµ��ӶԵ���Է���������С�ķ�����____________��
������VSEPRģ����ͬ������1�Թµ��ӶԵ���Է���������С�ķ�����____________��
��3��ͼ![]() ��ʾ������
��ʾ������![]() λ��__________λ�ã������������γɿ���ͨ����
λ��__________λ�ã������������γɿ���ͨ����![]() ����
����![]() ���������������Խ��ͣ�ԭ����_____________��
���������������Խ��ͣ�ԭ����_____________��
��4��ͼ![]() �У���ȱ�ݴ������
�У���ȱ�ݴ������![]() ������____________
������____________![]() ������������������
������������������![]() �ľ�������NaCl�����У�
�ľ�������NaCl�����У�![]() �����
�����![]() �ѻ����ɵ�___________�����϶�С�
�ѻ����ɵ�___________�����϶�С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ʵ����1.0 mol��L-1 NH4HCO3��Һ�� pH=8.0��ƽ��ʱ̼�ķֲ�ϵ��(����̼����Ũ��ռ��̼������Ũ��֮�͵ķ���)��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. ������Ka1(H2CO3)>Kb(NH3��H2O)>Ka2(H2CO3)
B. pH=13ʱ����Һ�в�����![]() ��ˮ��ƽ��
��ˮ��ƽ��
C. pH��8~11ʱ�� ![]() ����
����
D. pH=3ʱ����c(![]() )+c(NH3��H2O)=c(
)+c(NH3��H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com