
【题目】写出下列反应的化学方程式。
(1)AlCl3水解溶液呈酸性。________
(2)将TiCl4加入热水中生成TiO2·xH2O。________
(3)NaHCO3在水溶液中的电离方程式。__________
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解。___________
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隔绝空气加热至500℃时绿矾(硫酸亚铁晶体)能完全分解,某化学小组为探究分解产物的成分,选用下图所示装置进行实验(夹持装置略),A中固体完全分解后变为红棕色粉末。

下列说法不正确的是
A. 所选用装置的正确连接顺序为A-C-E-D-B
B. E装置是用来检验SO3,则X可以是硝酸酸化的硝酸钡溶液
C. 可选用酸性KMnO4溶液检验A装置中残留固体是否为Fe2O3
D. 该反应的化学方程式可能是2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
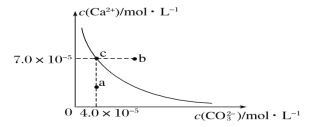
(1)通过蒸发,可使稀溶液由_______点变化到_______点。
(2)在25℃时,反应CaSO4(s)+CO32- (aq)CaCO3(s)+SO42-(aq)的平衡常数K_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是200mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300℃以下不变)

试回答下列问题:
(1)写出B点固体产物的化学式________________________________________;
(2)通过计算确定D点处产物的化学式______________________________。
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_____________________________________________。
(4)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液所得滴定曲线如图:
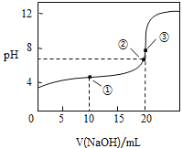
(1)在整个实验过程中,不需要的仪器是 ______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________c(CH3COO-)(填“>”“<”或“=”)。
(3)盛装标准NaOH溶液选择图中滴定管_________(填标号)。
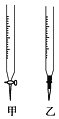
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________。
(5)下列操作会导致测定结果偏低的是______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、计算:血液中含钙离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、N为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与N分别同主族,在周期表中X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,Z、W的最外层电子数之和与M的核外电子总数相等。试回答下列问题:
![]() 、Z、W、N四种元素的原子半径由大到小的排列顺序是 ______
、Z、W、N四种元素的原子半径由大到小的排列顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() 。
。
![]() 由X、Z、W、N四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 ______ 。
由X、Z、W、N四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 ______ 。
![]() 由X、Z、W、N四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式 ______ 。
由X、Z、W、N四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式 ______ 。
![]() 由X、Z、W、N和Fe五种元素可组成类似明矾的化合物
由X、Z、W、N和Fe五种元素可组成类似明矾的化合物![]() 相对分子质量为
相对分子质量为![]() ,1molH中含有6mol结晶水。对化合物H进行如下实验:
,1molH中含有6mol结晶水。对化合物H进行如下实验:
![]() 取H的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
取H的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
![]() 另取H的溶液,加入过量的
另取H的溶液,加入过量的![]() 溶液产生白色沉淀,加盐酸沉淀不溶解。
溶液产生白色沉淀,加盐酸沉淀不溶解。
![]() 的化学式为 ______ 。
的化学式为 ______ 。
![]() 已知100mL
已知100mL![]() 的H溶液能与20mL
的H溶液能与20mL![]()
![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]() 恰好反应,写出该反应的离子方程式______。
恰好反应,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com