
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L 浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
D.常温常压下,92 g的NO2和N2O4混合气体中含有的氮原子数为3NA
【答案】B
【解析】
A.生成的气体所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故A错误;
B.32g铜的物质的量为n= ![]() =0.5mol,而铜与浓、稀硝酸反应后均变为+2价,故0.5mol铜反应失去NA个电子,由电子得失守恒可知,浓、稀硝酸得电子数均为NA个,故B正确;
=0.5mol,而铜与浓、稀硝酸反应后均变为+2价,故0.5mol铜反应失去NA个电子,由电子得失守恒可知,浓、稀硝酸得电子数均为NA个,故B正确;
C.过氧化钠由钠离子和过氧根离子构成,故1mol过氧化钠中含3NA个离子;甲烷中含4个C—H键,故1mol甲烷中含4NA个共价键,1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目不相等,故C错误;
D.常温常压下,92 g的NO2和N2O4混合气体中设NO2的物质的量为x,设N2O4的物质的量为y,由质量列出方程为46x+92y=92,解得x+2y=2,则92 g的NO2和N2O4混合气体中含有的氮原子的物质的量为x+2y=2(mol),含有的氮原子的数为2NA,故D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】铝元素之间的相互转化如图所示,下列叙述正确的是( )

A.实现①的转化,可通入过量CO2
B.实现②的转化,可加入过量NaOH溶液
C.实现③的转化,可加入过量NaOH溶液
D.实现④的转化,可通入过量NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置___。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是___(填元素符号)。
(3)元素的非金属性Z___Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___ (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)若使A按下列途径完全转化为F,F的化学式为___。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是

A. 图①可表示用NaOH溶液滴定等浓度醋酸溶液,溶液导电性随NaOH的体积变化
B. 图②可表示25℃时,0.10 molL-1盐酸滴定20.00mL0.10 molL-1NaOH溶液的滴定曲线
C. 图③表示水溶液中c(H+)与c(OH-)的变化关系,则水的电离程度(![]() ):
):![]() ;水的离子积:KW(d)=KW(b)
;水的离子积:KW(d)=KW(b)
D. 图④表示合成氨N2(g)+3H2(g) ![]() 2NH3(g) △H<0的平衡常数与温度和压强的关系
2NH3(g) △H<0的平衡常数与温度和压强的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____。
(4)25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______。
A. B.
B.
C.  D.
D.
(5)能证明醋酸是弱酸的实验事实是______(填写序号)。
① 相同条件下,浓度均为0.1 molL-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1molL-1 CH3COOH溶液可使紫色石蕊试液变红
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2molL-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8B.19.2C.25.6D.51.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有着重要应用。回答下列问题:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时还生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为___。
II.H2S可用于检测和沉淀金属阳离子。
(2)由H2S制得的水溶液为氢硫酸,向氢硫酸中滴加少量的硫酸铜溶液,溶液中![]() ___(填“增大”或“减小”)。
___(填“增大”或“减小”)。
(3)已知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=___(溶液体积变化忽略不计)。
III.H2S是煤化工原料气脱硫过程的重要中间体,反应原理如下:
i.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ·mol-1;
H2S(g)+CO(g) △H=+7kJ·mol-1;
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ·mol-1。
CO2(g)+H2(g) △H=-42kJ·mol-1。
(4)已知:断裂1mol分子中的化学键所需吸收的能量如下表所示:

表中x=___。
(5)向10L溶积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),进行上述两个反应。
①随着温度升高,CO的平衡体积分数___(填“增大”或“减小”),其原因是___。
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,CO的体积分数为5%。则该温度下,达到平衡时H2的物质的量为___;反应i的平衡常数为___(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
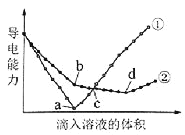
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(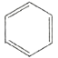 )看,78g苯中含有碳碳双键数为3NA
)看,78g苯中含有碳碳双键数为3NA
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com