
| A、向次氯酸钠溶液中通入少量二氧化硫:2ClO-+SO2+H2O=SO32-+2HClO |
| B、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| C、碳酸氢铵溶液与少量氢氧化钠溶液反应NH4++OH-═NH3?H2O |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| Ⅰ | Ⅱ | |
| A | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入少量Ba(OH)2溶液中 |
| B | 少量浓氨水滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入浓氨水中 |
| C | 0.1mol Cl2通入含0.2mol FeBr2的溶液中 | 0.3mol Cl2通入含0.2mol FeBr2的溶液中 |
| D | 过量稀硝酸与少量铁屑混合 | 少量稀硝酸与过量铁屑混合 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
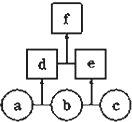 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )| A、常温下,单质a呈气态 |
| B、单质c具有强氧化性 |
| C、稳定性:d>e |
| D、f受热易分解为d和e |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2[CuSO4] |
| B、NaOH[NaOH] |
| C、NaCl[HCl] |
| D、CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S和NH3均是价电子总数为8的非极性分子 |
| B、HS-和HCl均是含一个极性键的18电子粒子 |
| C、CH2C12和CH4均是四面体构型的非极性分子 |
| D、1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) |
| B、1 mol?L-1HCN溶液与1mol?L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
| C、1mol/L醋酸溶液加水稀释,所有离子浓度均减小 |
| D、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入浓氢氧化钠溶液都产生红褐色沉淀 |
| B、都能发生丁达尔现象 |
| C、分散质颗粒直径都在l~100nm之间 |
| D、颜色都呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=m+1 |
| B、n=m+8 |
| C、n=m+11 |
| D、n=m+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
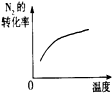
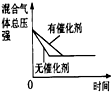
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com