
| A、加入浓氢氧化钠溶液都产生红褐色沉淀 |
| B、都能发生丁达尔现象 |
| C、分散质颗粒直径都在l~100nm之间 |
| D、颜色都呈红褐色 |


科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②③④⑤ |
| C、②③④⑤ | D、①⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
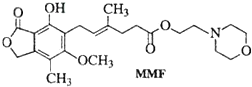
| A、MMF难溶于水 |
| B、MMF能发生氧化反应和消去反应 |
| C、MMF与浓溴水反应,但不能产生白色沉淀 |
| D、1mol MMF最多能与含3mol NaOH的水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向次氯酸钠溶液中通入少量二氧化硫:2ClO-+SO2+H2O=SO32-+2HClO |
| B、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| C、碳酸氢铵溶液与少量氢氧化钠溶液反应NH4++OH-═NH3?H2O |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+,Na+,Cl-,NO3- |
| B、Cu2+,NO3-,OH-,HCO3- |
| C、CO32-,OH-,Cl-,K+ |
| D、NH4+,H+,Cl-,Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol Fe与足量盐酸反应,转移的电子数为0.3NA |
| B、0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA |
| C、标况下,22.4L汽油的分子数为NA |
| D、常温常压下,36.5g HCl溶于水形成1L溶液,其物质的量浓度为1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 50 |
| 1 |
| 50 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| 催化剂 |
投料比[
|
500K | 600K | 700K | 800K | ||
| 1.5 | 45% | 33% | 20% | 12% | ||
| 2.0 | 60% | 43% | 28% | 15% | ||
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
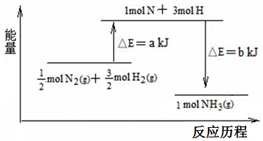 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com