(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知:①2CH
4(g)+3O
2(g)═2CO(g)+4H
2O(1);△H
1=-1214.6kJ/mol;
②2CO(g)+O
2(g)═CO
2(g);△H
2=-566kJ/mol
则反应CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(1)的△H=
(2)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:
CO+Hb?O
2?O
2+Hb?CO.实验表明,c(Hb?CO)即使只有c(Hb?O
2)的
,也可造成人的智力损伤.已知t℃时上述反应的平衡常数K=200,吸入肺部O
2的浓度约为1.0×10
-2mol?L
-1,若使c(Hb?CO)小于c(Hb?O
2)的
,则吸入肺部CO的浓度不能超过
mol?L
-1.
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H
2O(g)?H
2(g)+CO
2(g)的平衡常数随温度的变化如下表,试回答下列问题
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
①在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
(选填A、B、C、D).
|
A |
B |
C |
D |
| n(CO2) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
②25℃时,将a mol NH
4NO
3溶于水,向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为
mol?L
-1(用含a、b的代数式表示,NH
3?H
2O的电离平衡常数为K
b=2×10
-5)
(4)将燃煤废气中的CO
2转化为甲醚的反应原理为:
2CO
2(g)+6H
2(g)
CH
3OCH
3(g)+3H
2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO
2的转化率见下表:
| 投料比[] |
500K |
600K |
700K |
800K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H
0,熵变△S
0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
.若以4.48L?min
-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解100mL 2mol?L
-1 CuSO
4溶液,通电0.5min后,理论上可析出金属铜
g.



 小学期末标准试卷系列答案
小学期末标准试卷系列答案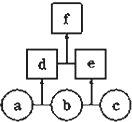 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )