
| ||
| 8.7g |
| 87g/mol |
| 8.7g |
| 87g/mol |
| ||
| 1 |
| 0.1 |
| 22.4L |
| x |
| 1 |
| 0.1mol |
| 4 |
| y |
| 57.4g |
| 143.5g/mol |
| 0.6mol |
| 0.05L |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
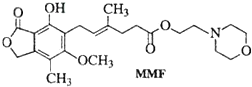
| A、MMF难溶于水 |
| B、MMF能发生氧化反应和消去反应 |
| C、MMF与浓溴水反应,但不能产生白色沉淀 |
| D、1mol MMF最多能与含3mol NaOH的水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 50 |
| 1 |
| 50 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| 催化剂 |
投料比[
|
500K | 600K | 700K | 800K | ||
| 1.5 | 45% | 33% | 20% | 12% | ||
| 2.0 | 60% | 43% | 28% | 15% | ||
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
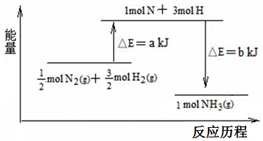 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下混合气体:H2、F2、NO、O2 |
| B、能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C、c(H+)=1.0 mol?L-1的溶液中:K+、Fe3+、SO42-、I- |
| D、澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com