
| A | B | C | D | |
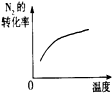
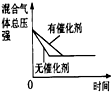
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
| m |
| n |
| m |
| V |
| ||
| 5min |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、向次氯酸钠溶液中通入少量二氧化硫:2ClO-+SO2+H2O=SO32-+2HClO |
| B、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| C、碳酸氢铵溶液与少量氢氧化钠溶液反应NH4++OH-═NH3?H2O |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 50 |
| 1 |
| 50 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| 催化剂 |
投料比[
|
500K | 600K | 700K | 800K | ||
| 1.5 | 45% | 33% | 20% | 12% | ||
| 2.0 | 60% | 43% | 28% | 15% | ||
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
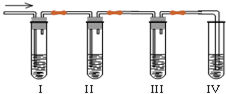 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
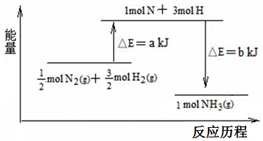 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶入极微量的银离子,可以杀死牛奶中的细菌,防止牛奶变质 |
| B、用银器盛放牛奶,可以补充人体所需的银元素 |
| C、银易导热,牛奶凉得快 |
| D、银的化学性质稳定,坚固耐用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com