
【题目】下列药品在实验室中能存放在同一橱柜中的是( )
①NaOH ②浓硫酸 ③浓盐酸 ④KOH ⑤金属钠 ⑥酒精 ⑦苯
A. ⑤和⑥、④和⑤ B. ②和③、①和②
C. ②和③、⑥和⑦ D. ④和⑤、④和⑥
科目:高中化学 来源: 题型:
【题目】鉴别下列各组物质,只能采用焰色反应的是( )
A.K2CO3 和NaCl
B.KCl和NaNO3
C.NaCl 和MgCl2
D.NaCl 和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
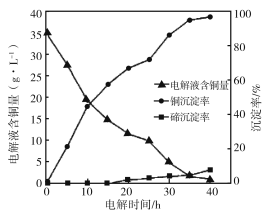
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L H2SO4溶液的叙述错误的是( )
A.1 L该溶液中含有H2SO4的质量为9.8 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L
C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请按要求回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素的原子结构示意图为: ;
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应的水化物反应的离子方程式: ;
(3)元素④与元素⑦形成的化合物中的化学键类型是 ,写出该化合物的电子式: ;
(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中酸性最弱的是 (填化学式);
(5)元素③与元素⑩两者核电荷数之差是 ;
(6)气态氢化物能与其最高价氧化物对应的水化物反应生成盐的元素是: (填序号);
(7)④⑤⑥⑦四种元素的简单离子的半径由大到小的顺序为: (填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O
CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是_____________。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2 ![]() I2
I2 ![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L-1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
A.金属铝均剩余
B.金属铝均溶解
C.盐酸中铝剩余,而氢氧化钠中铝全部溶解
D.氢氧化钠这铝剩余,而盐酸中铝全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的CO2 分别通入:①CaCl2 溶液 ②NaAlO2 溶液 ③Ca(OH)2 溶液 ④饱和Na2CO3 溶液。最终溶液中有白色沉淀析出的是
A. ①③ B. ②④ C. ①②③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com