
【题目】下列物质中,不能使品红溶液褪色的是( )
A.Cl2
B.HCl
C.SO2
D.活性炭
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是______,原子数之比是______,质量之比是______,密度之比是______
(2)下列所给出的几组物质中:含有分子数最多的是_________;含有原子数最多的是_________;标准状况下体积最大的是____________。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是_________________(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
氮和氧是地球上极为丰富的元素。请回答下列问题:
(1)从原子轨道重叠方式考虑,氮分子中的共价键类型有____________;氮分子比较稳定的原因是_________。
(2)C、N、O的第一电离能由大到小的顺序为_____________(用元素符号表示);NH3易溶于水而CH4难溶于水的原因是____________________________________________。
(3)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的核外电子运动状态有____种;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。
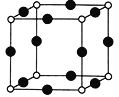
②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
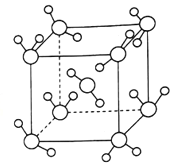
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下表有关铁难溶化合物的溶度积,有关说法正确的是
化合物 | 溶度积(25℃) | 化合物 | 溶度积(25℃) |
FeCO3 | 3.2×10-11 | Fe(OH)3 | 4.0×10-38 |
Fe(OH)2 | 8.0×10-11 | FeS | 6.3×10-18 |
A. 在c(CO32-)=0.1 mol·L-1的溶液中,c(Fe2+)≥3.2×10-10 mol·L-1
B. 将FeCl3和 FeCl2溶液分别调至PH=10,则c(Fe2+)< c(Fe3+)
C. 增加溶液的酸性,有利于将Fe2+沉淀为FeS和FeCO3
D. 将反应液中的Fe2+氧化为 Fe3+有利于将铁从溶液中除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸和强碱的稀溶液中和时,中和热为57.3kJ,试计算:
(1)浓度为0.1mol·L-1的NaOH溶液200mL,与足量酸反应时,能放出多少千焦的热量_____?
(2)浓度为5%的H2SO4溶液980g,与足量的NaOH溶液反应,能放出多少热量______ ?
(3)用浓度为0.2mol·L-1的HNO3 100mL,与足量的NaOH溶液反应,能放出多少热量_____ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的某试剂充分反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_____________(填化学式)而除去。
(2)①中加入的试剂应该选择_____为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式:______________________________。
(4)下列与方案③相关的叙述中,正确的是__________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.在pH<4 的溶液中Fe3+一定不能大量存在
C.调节溶液pH=4 可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4 的溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E 都含X元素,其转化关系如下图所示。

(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A _____,B _____,C ______,D_____,E___________。
(2)写出下列反应的化学方程式:
A+H2O:______________;
A+NaOH:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室常用的装置,请根据要求回答问题:
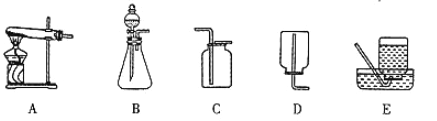
(1)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为________________________,选用的气体发生装置是_________(填装置序号)。反应结束后,若要过滤分离出二氧化锰,除了玻璃棒外,还需要补充的玻璃仪器名称是__________、__________
(2)实验室可用碳酸钙固体与盐酸在常温下混合制取二氧化碳,选用的气体发生装置是________(填装置序号)。发生反应的化学方程式为:____________________________________
(3))下图中的C、D、E三种装置,均可用下图的F装置代替。若用F装置进行排空气法收集二氧化碳,二氧化碳应从F装置的_______(填“a”或“b”,下同)口通入;若用F装置进行排水法收集氧气,可先在F装置中装满水,然后将氧气从F装置的_______口通入。

(4)将二氧化碳通入紫色石蕊溶液中,溶液变成红色,加热后溶液又变成紫色。用化学方程式表示加热后溶液又变成紫色的原因是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.硫元素的不同单质S2与S8互为同素异形体B.35Cl2和37Cl2互为同位素
C.(CH3)2CHCH3和CH3(CH2)2CH3互为同分异构体D.甲苯和间二甲苯互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com