
【题目】[化学一选修3:物质结构与性质]
氮和氧是地球上极为丰富的元素。请回答下列问题:
(1)从原子轨道重叠方式考虑,氮分子中的共价键类型有____________;氮分子比较稳定的原因是_________。
(2)C、N、O的第一电离能由大到小的顺序为_____________(用元素符号表示);NH3易溶于水而CH4难溶于水的原因是____________________________________________。
(3)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的核外电子运动状态有____种;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。
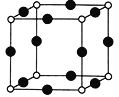
②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
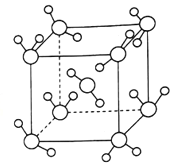
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
【答案】 σ键和π键 氮氮叁键的键能大 N>O>C NH3和H2O分子间形成氢键,CH4为非极性分子,不易溶于水 29 1s22s22p6 6 氮 平面正方形 sp3 1.61
【解析】(1)氮气分子的结构式为NN,其中的共价键类型为一个σ键和两个π键,氮气分子比较稳定的原因就是氮氮叁键的键能大,不易被破坏;
(2)由于同周期元素的第一电离能从左到右一般是逐渐增大的,但N元素最外层的2p上只有3个电子,属于半满状态,比较稳定,所以N元素的第一电离能大于O元素的,因此C、N、O的第一电离能由大到小的顺序为N>O>C;NH3分子中的N元素和水分子中的O元素都具有强的吸引电子能力,它们通过H原子在NH3分子和水分子间形成氢键,因此NH3易溶于水,但CH4中的C元素没有强的吸引电子能力,且CH4为非极性分子,所以不能溶于极性的水中;
(3) ①X+中所有电子恰好充满K、L、M3个电子层,则X原子核外电子数为2+8+18+1 =29,即X是29号元素Cu,因为原子核外没有运动状态完全相同的两个电子存在,所以Cu原子核外电子的运动状态共有29种;基态N3-的电子排布式为1s22s22p6;由晶体结构图可知与N3-等距离且最近的X+有6个,分别在棱的中点,位于N3-的上下、左右、前后六个位置;②NH3分子中的N原子上有孤电子对,所以两种配离子中提供孤电子对的原子为氮元素;已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,说明该离子为正四面体结构,其中Zn以sp3杂化提供四个完全等效的共价键,而[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,说明该离子为平面正方形结构,两个氯原子在同一边上或在对角线上,是两种不同的结构;
(4)根据重冰的结构可知,其中含有2个水分子,所以该晶胞的质量为![]() =
=![]() g,其体积为a3=(3.337×10-8cm)3=3.72×10-23cm3,所以其密度为
g,其体积为a3=(3.337×10-8cm)3=3.72×10-23cm3,所以其密度为![]() /3.72×10-23cm3 = 1.61 g/cm3。
/3.72×10-23cm3 = 1.61 g/cm3。


科目:高中化学 来源: 题型:
【题目】加成反应是有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应。下列过程与加成反应无关的是( )
A. 苯与溴水混合振荡,水层颜色变浅
B. 裂化汽油与溴水混合振荡,水层颜色变浅
C. 乙烯与水在一定条件下反应制取乙醇
D. 乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是】
①根据红外光谱图的分析可以初步判断有机物中具有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差一定为8的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似
A. 只有①②③ B. ①②③④ C. 只有①③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成物总能量高于反应物总能量的是 ( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. NaOH溶液与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为_____。
(2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为_____。
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。
实验结论:A中含有的官能团(名称):_____。
(4)A的核磁共振氢谱如图。实验结论:A中含有_____种氢原子。
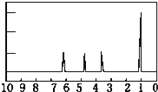
(5)综上所述,A的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一选修5:有机化学基础]
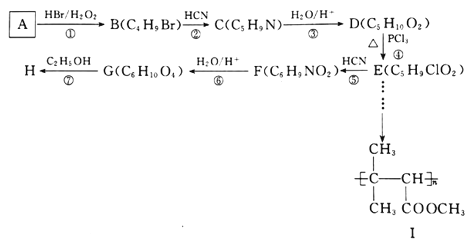
有机物H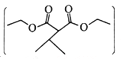 是一种常见的有机合成中间体,在染料、香料、磺酰脲类除草剂等生产中用途广泛,以有机物A为原料合成H的路线如下所示:
是一种常见的有机合成中间体,在染料、香料、磺酰脲类除草剂等生产中用途广泛,以有机物A为原料合成H的路线如下所示:
已知:I. ![]()
II. ![]()
III. 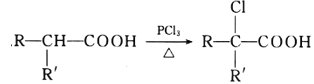
请回答下列问题:
(1)A的化学名称为________________________,分子中共面的原子数最多为_____个。
(2)E分子中所含官能团的名称为________________,②的反应类型为______________。
(3)F的结构简式为_____________________,写出反应⑦的化学方程式:___________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有_____种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的所有同分异构体的结构简式:_______________________。
(5)设计一条由E到I的合成路线。合成路线示例如下:
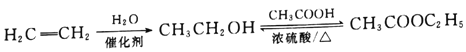
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 标准状况下,56 g Fe的体积约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com