
【题目】下列说法中错误的是】
①根据红外光谱图的分析可以初步判断有机物中具有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差一定为8的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似
A. 只有①②③ B. ①②③④ C. 只有①③④ D. ②④
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是______,原子数之比是______,质量之比是______,密度之比是______
(2)下列所给出的几组物质中:含有分子数最多的是_________;含有原子数最多的是_________;标准状况下体积最大的是____________。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是_________________(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以直接氧化PCl3制备POCl3。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):

部分物质的性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3,缓慢通入氧气POCl3产率较高 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
实验步骤如下
I.连接仪器,检查装置气密性。关闭K1、K2 打开K3、K4,点燃酒精灯制备气体。
II.缓慢向C中通入适量气体至C中白磷消失,熄灭酒精灯。
III.关闭K3、K4,打开K1、K2 ,A中开始发生反应。
IV.C装置控制反应在60℃~65℃,最终制得POCl3产品。
回答下列问题:
(1)B、D装置中盛放的试剂是_______,B装置的作用除了干燥O2和平衡气压之外,还有___。
(2)仪器a的名称是______,装置E 中发生反应的离子方程式为____________。
(3)步骤IV 控制温度60℃~65℃,其主要目的是____________。
(4)该实验装置存在一处明显的设计缺陷是_______________。
(5)通过下面步骤可以测定三氯氧磷产品中Cl 的含量:
I.取xg产品于锥形瓶中,加入足量NaOH 溶液,PCl3完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
III.向其中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
(己知: Ag3PO4溶于酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10 -12)
①滴定选用的指示剂是_____(填标号)
a.酚酞 b.淀粉 c.NH4Fe(SO4)2 d.甲基橙
②元素Cl的质量分数为(列出算式)________________。
③步骤III若不加入硝基苯,所测Cl含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
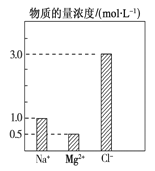
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
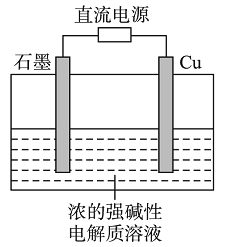
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
氮和氧是地球上极为丰富的元素。请回答下列问题:
(1)从原子轨道重叠方式考虑,氮分子中的共价键类型有____________;氮分子比较稳定的原因是_________。
(2)C、N、O的第一电离能由大到小的顺序为_____________(用元素符号表示);NH3易溶于水而CH4难溶于水的原因是____________________________________________。
(3)X+中所有电子恰好充满K、L、M3个电子层。
①X+与N3-形成的晶体结构如图所示。X原子的核外电子运动状态有____种;基态N3-的电子排布式为______;与N3-等距离且最近的X+有______个。
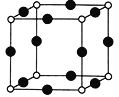
②X2+和Zn2+分别可与NH3形成[X(NH3)4]2+、[Zn(NH3)4]2+,两种配离子中提供孤电子对的原子均为_______(写元素名称)。已知两种配离子都具有对称的空间构型,[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种结构的产物,而[X(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种结构不同的产物,则[X(NH3)4]2+的空间构型为_______;[Zn(NH3)4]2+中Zn的杂化类型为_______________。
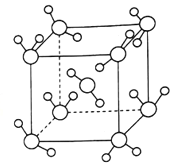
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E 都含X元素,其转化关系如下图所示。

(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A _____,B _____,C ______,D_____,E___________。
(2)写出下列反应的化学方程式:
A+H2O:______________;
A+NaOH:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com