
����Ŀ��[��ѧһһѡ��5:�л���ѧ����]
�л���H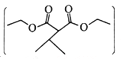 ��һ�ֳ������л��ϳ��м��壬��Ⱦ�ϡ����ϡ�����������ݼ�����������;�㷺�����л���AΪԭ�Ϻϳ�H��·��������ʾ:
��һ�ֳ������л��ϳ��м��壬��Ⱦ�ϡ����ϡ�����������ݼ�����������;�㷺�����л���AΪԭ�Ϻϳ�H��·��������ʾ:
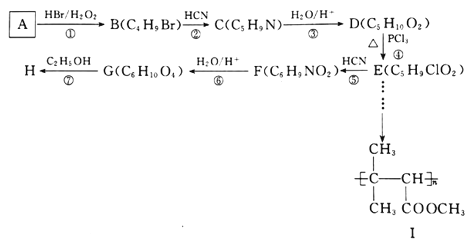
��֪��I. ![]()
II. ![]()
III. 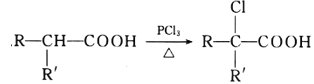
��ش���������:
(1)A�Ļ�ѧ����Ϊ________________________�������й����ԭ�������Ϊ_____����
(2)E���������������ŵ�����Ϊ________________�����ķ�Ӧ����Ϊ______________��
(3)F�Ľṹ��ʽΪ_____________________��д����Ӧ���Ļ�ѧ����ʽ:___________________________��
(4)D��ͬ���칹�������ܷ���������Ӧ���������Ʒ�Ӧ�ų�H2�Ĺ���_____����д���˴Ź���������4������ҷ������Ϊ1:1:2:6������ͬ���칹��Ľṹ��ʽ:_______________________��
(5)���һ����E��I�ĺϳ�·�ߡ��ϳ�·��ʾ�����£�
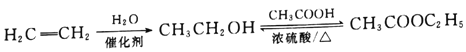
���𰸡� 2-��-1-��ϩ 8 �Ȼ�����ԭ�� ȡ����Ӧ 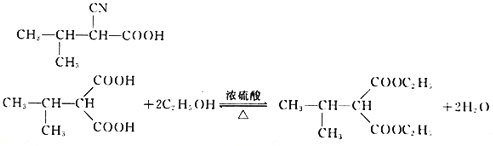 12
12 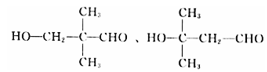
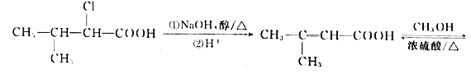
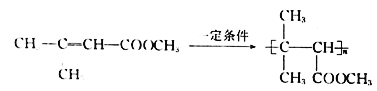
��������(1)������֪��ӦI��֪A�к���C=C�����ݸ߾���I����֪A�к���������CH3����B�Ļ�ѧʽ��֪A�Ļ�ѧʽΪC4H8����A�Ļ�ѧ����Ϊ2-��-1-��ϩ�������й����ԭ�����Ϊ8�����ֱ���C=C���˸���3�����������ϸ���һ����ԭ�������ĸ�Cԭ�Ӻ��ĸ�Hԭ�ӹ�����
(2)���ݷ�ӦI��B�Ľṹ��ʽΪ(CH3)2CH��CH2Br���ɷ�ӦII��֪D�Ľṹ��ʽΪ(CH3)2CH��CH2��COOH�����ݷ�ӦIII�Ƴ�E�Ľṹ��ʽΪ(CH3)2CH��CHCl��COOH������E�����������ŵ�����Ϊ�Ȼ�����ԭ�����ڵķ�Ӧ��-CNȡ����Br���䷴Ӧ����Ϊȡ����Ӧ��
(3)��E����F����-CNȡ����Cl������F�Ľṹ��ʽΪ(CH3)2CH��CH(CN)��COOH����Ӧ�ߵĻ�ѧ����ʽΪ
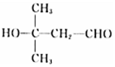
(4) D�Ļ�ѧʽΪC5H10O2���ܷ���������Ӧ�����С�CHO�������Ʒ�Ӧ�ų�H2��������OH��ʣ���4��Cԭ�������ֽṹ���ֱ���C��C��C��C��CHO��![]() ��
��![]() ��
��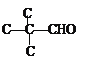 ����ô�ǻ���λ�÷ֱ���4����3����4�ֺ�1�֣����Է���Ҫ���ͬ���칹�干��12�֣����к˴Ź���������4��壬�ҷ������Ϊ1:1:2:6������ͬ���칹��Ľṹ��Ϊ
����ô�ǻ���λ�÷ֱ���4����3����4�ֺ�1�֣����Է���Ҫ���ͬ���칹�干��12�֣����к˴Ź���������4��壬�ҷ������Ϊ1:1:2:6������ͬ���칹��Ľṹ��Ϊ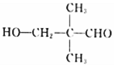 ��
�� ��
��
(5)ͨ�����Ϸ�������֪E�Ľṹ��ʽΪ(CH3)2CH��CHCl��COOH����I�Ľṹ��ʽΪ ������Ҫ�ȶ�E������ȥ��Ӧ��ȥ��Clԭ���γ�C=C˫�����ٽ�����������֮�����ɵ����ڼ��������»�ˮ�⣬�����ڲ�������ɣ�����ټӾ۵õ�Ҫ�Ʊ��IJ�����������ϳ���·Ϊ
������Ҫ�ȶ�E������ȥ��Ӧ��ȥ��Clԭ���γ�C=C˫�����ٽ�����������֮�����ɵ����ڼ��������»�ˮ�⣬�����ڲ�������ɣ�����ټӾ۵õ�Ҫ�Ʊ��IJ�����������ϳ���·Ϊ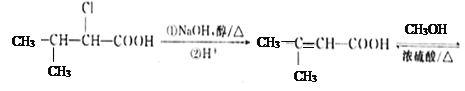
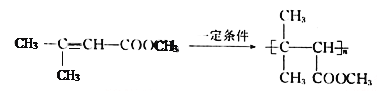 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ���ң�����ܷ�ӦΪ��2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����
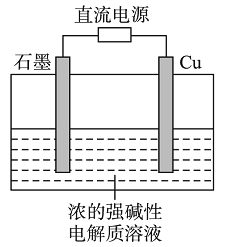
A. ʯī�缫�ϲ�������
B. ͭ�缫������ԭ��Ӧ
C. ͭ�缫��ֱ����Դ�ĸ���
D. ����0.1 mol����ת��ʱ����0.1 mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��3:���ʽṹ������]
�������ǵ����ϼ�Ϊ�ḻ��Ԫ�ء���ش���������:
(1)��ԭ�ӹ���ص���ʽ�������������еĹ��ۼ�������____________�������ӱȽ��ȶ���ԭ����_________��
(2)C��N��O�ĵ�һ�������ɴ�С��˳��Ϊ_____________(��Ԫ�ط��ű�ʾ)��NH3������ˮ��CH4������ˮ��ԭ����____________________________________________��
(3)X+�����е���ǡ�ó���K��L��M3�����Ӳ㡣
��X+��N3-�γɵľ���ṹ��ͼ��ʾ��Xԭ�ӵĺ�������˶�״̬��____������̬N3-�ĵ����Ų�ʽΪ______����N3-�Ⱦ����������X+��______����
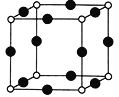
��X2+��Zn2+�ֱ����NH3�γ�[X(NH3)4]2+��[Zn(NH3)4]2+���������������ṩ�µ��ӶԵ�ԭ�Ӿ�Ϊ_______(дԪ������)����֪���������Ӷ����жԳƵĿռ乹����[Zn(NH3)4]2+�е�����NH3������Cl-ȡ��ֻ�ܵõ�һ�ֽṹ�IJ�������[X(NH3)4]2+�е�����NH3������Cl-ȡ���ܵõ����ֽṹ��ͬ�IJ����[X(NH3)4]2+�Ŀռ乹��Ϊ_______��[Zn(NH3)4]2+��Zn���ӻ�����Ϊ_______________��
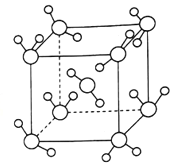
(4)�����о�������ˮ�������13�����͵Ľᾧ�塣����ͨ����������-30�������̵ĵ��±���180����Ȼ������ȱ�����ˮ�ܶȴ���ر��ȡ��ر��Ľṹ��ͼ��ʾ����֪��������a=333.7pm�������ӵ�������ֵȡ6.02��1023�����ر����ܶ�Ϊ_______g.cm-3(��������ȷ��0.01)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ����ƣ�Na2Cr2O72H2O���׳ƺ췯�ƣ��ڹ�ҵ���й㷺��;���ҹ�Ŀǰ��Ҫ���Ը�������Ҫ�ɷ�ΪFeOCr2O3��������Al2O3��MgO��SiO2�����ʣ�Ϊ��Ҫԭ�Ͻ�������������Ҫ�����������£�

�����漰����Ҫ��Ӧ�У�
����Ӧ��4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
����Ӧ��SiO2+Na2CO3![]() Na2SiO3+CO2����Al2O3+Na2CO3
Na2SiO3+CO2����Al2O3+Na2CO3![]() 2NaAlO2+CO2��
2NaAlO2+CO2��
����������������������ʽ��ȫ����ʱ��Һ��pH��
������ | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
��ȫ����ʱ��ҺpH | 4.7 | 3.7 | 11.2 | 5.6 |
�Իش��������⣺
��1�����з�Ӧ���ڻ�תҤ�н��У���Ӧʱ�費�Ͻ��裬��������___________��
��2�����е���pH��4.7��Ŀ����____________________________��
��3�����м������ữ��Ŀ����ʹCrO42��ת��ΪCr2O72������д����ƽ��ת�������ӷ���ʽ��___________________________��
��4����ȡ�ظ���������2.5000g���250mL��Һ��ȡ��25.00mL�ڵ���ƿ�У�����10mL 2molL��1H2SO4������NaI�����Ļ�ԭ����ΪCr3+�������ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.1200molL��1Na2S2O3����Һ�ζ���
����֪��I2+2S2O32��=2I��+S4O62����
���жϴﵽ�ζ��յ�������ǣ�__________________________��
����ʵ���й���ȥNa2S2O3����Һ40.00ml�����ò�Ʒ�����ظ����ƵĴ���Ϊ���������������������ʲ����뷴Ӧ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±��й������ܻ�������ܶȻ����й�˵����ȷ����
������ | �ܶȻ���25���� | ������ | �ܶȻ���25���� |
FeCO3 | 3.2��10��11 | Fe(OH)3 | 4.0��10��38 |
Fe(OH)2 | 8.0��10��11 | FeS | 6.3��10��18 |
A. ��c(CO32-)=0.1 mol��L-1����Һ�У�c(Fe2+)��3.2��10-10 mol��L-1
B. ��FeCl3�� FeCl2��Һ�ֱ����PH=10����c(Fe2+)< c(Fe3+)
C. ������Һ�����ԣ������ڽ�Fe2+����ΪFeS��FeCO3
D. ����ӦҺ�е�Fe2+����Ϊ Fe3+�����ڽ�������Һ�г���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǿ���ǿ���ϡ��Һ�к�ʱ���к���Ϊ57.3kJ���Լ��㣺
��1��Ũ��Ϊ0.1mol��L��1��NaOH��Һ200mL���������ᷴӦʱ���ܷų�����ǧ��������_____��
��2��Ũ��Ϊ5%��H2SO4��Һ980g����������NaOH��Һ��Ӧ���ܷų���������______ ��
��3����Ũ��Ϊ0.2mol��L��1��HNO3 100mL����������NaOH��Һ��Ӧ���ܷų���������_____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�A�ǿ�����������ˮ���������Ļ���ɫ�������壬A��B��C��D��E ����XԪ�أ���ת����ϵ����ͼ��ʾ��

��1����ֱ�д��A��B��C��D��E�Ļ�ѧʽ(��Ϊ��Һ�������ʵĻ�ѧʽ����
A _____��B _____��C ______��D_____��E___________��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ:
A+H2O��______________��
A+NaOH��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɫ��Һͨ��SO2ʱ������ɫ���ɫ����ʵ����ͬ���ǣ� �� ��Ʒ����Һ ������KMnO4��Һ �۵��з�̪��NaOH��Һ
����ˮ ��ʯ����Һ��
A.�٢�
B.�٢�
C.�٢ڢ�
D.�ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com