
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的某试剂充分反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_____________(填化学式)而除去。
(2)①中加入的试剂应该选择_____为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式:______________________________。
(4)下列与方案③相关的叙述中,正确的是__________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.在pH<4 的溶液中Fe3+一定不能大量存在
C.调节溶液pH=4 可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4 的溶液中
【答案】 Fe(OH)3 NH3·H2O 2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ ACD
【解析】试题分析:在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的氨水,充分反应,过滤除去氢氧化铁,滤液结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤除去氢氧化铁、结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤除去氢氧化铁、结晶即可。
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为Fe(OH)3而除去。
(2)为了防止引入杂质,①中加入的试剂应该选择NH3·H2O为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ 。
(4)与方案③相关的叙述中,A.H2O2是绿色氧化剂,其还原产物为水,在氧化过程中不引进杂质、不产生污染,A正确;B.在pH<4的溶液中Fe3+有可能大量存在,因为氢氧化铁可溶于酸,依据题意,在pH![]() 4的溶液中,Fe3+不能大量存在,B不正确;C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜,这样可以防止引入杂质,C正确;D.依据题意知,Cu2+可以大量存在于pH=4的溶液中,D正确。综上所述,正确的是ACD。
4的溶液中,Fe3+不能大量存在,B不正确;C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜,这样可以防止引入杂质,C正确;D.依据题意知,Cu2+可以大量存在于pH=4的溶液中,D正确。综上所述,正确的是ACD。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β-羰基酯,同时失去一分子醇,该反应称克菜森(R·L·Claisen)酯缩合反应,其反应机理如下:
2RCH2COOC2H5 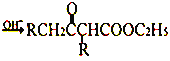 +C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
+C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
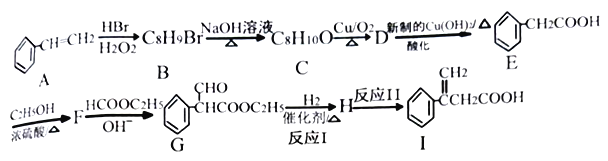
回答下列问题:
(1)E的名称为_______,F的结构简式为_______。
(2)I中官能团的名称是_______,反应I的反应类型是_______。
(3)F→G反应的化学方程式为_______。
(4)满足下列条件E的同分异构体有_____种。
①含有苯环,能发生水解反应 ②分子结构中含有一个甲基
其中分子结构中只有一个侧链的有机物结构简式为______、_______。
(5)乙酰乙酸乙酯(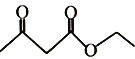 )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为_____。
(2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为_____。
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。
实验结论:A中含有的官能团(名称):_____。
(4)A的核磁共振氢谱如图。实验结论:A中含有_____种氢原子。
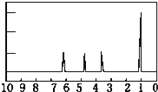
(5)综上所述,A的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
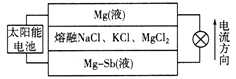
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
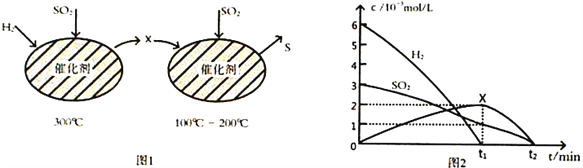
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
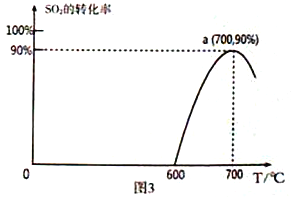
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法错误的是
A. 标况下,2.24L的CO和CO2的混合气体中所含碳原子数为0.1NA
B. 常温常压下,46g的NO2中含有NO2的分子数为NA
C. 常温常压下,32g的O2和32g的O3所含氧原子数都是2NA
D. 含1mol Fe(OH)3的该胶体中,胶体粒子数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是 ( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①③⑤ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
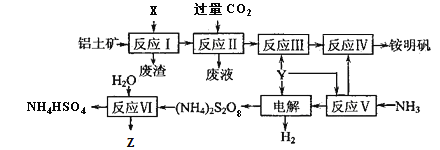
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com