
【题目】配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
科目:高中化学 来源: 题型:
【题目】水(H2O)在很多化学反应中具有极其重要的作用.请研究下列水参与的氧化还原反应.
①NaH+H2O═NaOH+H2↑
②2Na2O2+2H2O═4NaOH+O2↑
③Na+2H2O═2NaOH+H2↑
④3NO2+H2O═2HNO3+NO
⑤2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O═4HF+O2
水只作氧化剂的是;水只作还原剂的是;水既作氧化剂,又作还原剂的是;水既不作氧化剂,又不是还原剂的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol F与A元素的最高价氧化物反应时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:

(1)门捷列夫的突出贡献是________。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明________。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到________。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子![]() X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________。
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________。
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (gCO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①△H(填“>”、“<”或“=”)0.
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ![]() ,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
③图中的B点处,NH3的平衡转化率 为 . 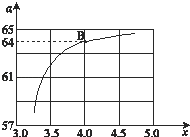
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用CO2和H2生成甲醇,热化学方程式如下: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+ ![]() O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
②H2O(g)=H2O(I)△H=Q3kJmol﹣1
则表示甲醇的燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法正确的是( )
A.等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X﹣)>c(H+)>c(OH﹣)
B.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32﹣)的大小关系为:②>④>③>①
C.往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 ![]() 增大
增大
D.Na2CO3溶液中,2c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中含量在万分之一以上的元素,称为大量元素;含量在万分之一以下的元素,称为微量元素。下列各组元素中,全部是大量元素的是( )
A.O S Mg C HB.Mo H O S Ca
C.Cu N P K FeD.P N K Ca B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com