
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (gCO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①△H(填“>”、“<”或“=”)0.
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ![]() ,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
③图中的B点处,NH3的平衡转化率 为 . 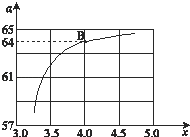
【答案】<;NH3的量增大,平衡正向移动,则增大CO2的转化率;32%
【解析】解:①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,所以答案是:<; ②2NH3 (g)+CO2 (g)CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,二氧化碳转化率增大, 所以答案是:NH3的量增大,平衡正向移动,则增大CO2的转化率; ③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率= ![]() ×100%=32%,
×100%=32%,
所以答案是:32%.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应.
氧化反应:H2O2﹣2e﹣═2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O
(1)写出该氧化还原反应的化学方程式: .
(2)反应中氧化剂是;被氧化元素是;若有0.5mol H2O2参加此反应,电子转移个数为 .
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为;这时若有0.5mol H2O2发生分解,电子转移个数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.纯净物一定由分子构成
B.混合物肯定由两种以上元素组成
C.同种分子构成的物质一定是纯净物
D.含有氧元素的化合物都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2molSO2的叙述中,正确的是( )
A.体积为44.8 LB.含有4mol氧原子
C.分子数为6.02×1023D.摩尔质量为128 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.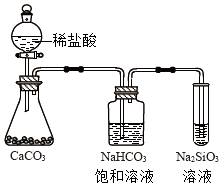
如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作合理的是( )
A. 用酒精萃取碘水中的碘单质 B. 用托盘天平称取5.20 g氯化钠
C. 用100 mL量筒量取5.20 mL盐酸 D. 用坩埚钳取下灼热的蒸发皿
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com