
| A. | ①②③ | B. | ①③ | C. | ①②③④ | D. | ③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题

| A. | 当该卤代烃发生水解反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| C. | 当该卤代烃发生消去反应时,被破坏的键是①和④ | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; +2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$
+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$ +2Ag+3NH3+H2O;
+2Ag+3NH3+H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.| A | |||||||
| B | C | D | E | ||||
| F | G | H | |||||
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,①的最高价氧化物的电子式为
,①的最高价氧化物的电子式为 .
.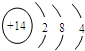 ,其最高价氧化物形成的晶体类型为原子晶体.
,其最高价氧化物形成的晶体类型为原子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,⑦元素的名称是硅,⑨元素的离子的电子式是
,⑦元素的名称是硅,⑨元素的离子的电子式是 ,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”).
,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”). .用电子式表示⑤与⑧形成化合物的形成过程
.用电子式表示⑤与⑧形成化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯、金刚石都属于单质 | B. | 漂白粉、CuSO4•5H2O都属于混合物 | ||
| C. | 次氯酸、氨气都属于电解质 | D. | 蛋白质、油脂都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +HCl
+HCl
 ,其反应类型为取代反应
,其反应类型为取代反应 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 除氢元素外,非金属元素都在p区,d区元素全部是金属.
除氢元素外,非金属元素都在p区,d区元素全部是金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com