
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )
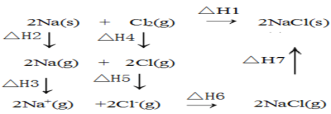
A.△H2+△H3+△H4+△H5+△H6+△H7=△H1
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H5<0,在相同条件下,2Br(g)的△H5′<△H5
D.△H7<0,且该过程形成离子键
科目:高中化学 来源: 题型:
【题目】(1)“84”消毒液是一种常用的消毒剂,其有效成分是______(填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____。
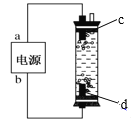
(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____(写出离子方程式)向逆方向移动;二是吸收空气中的_____(填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
请你写出pH降低时产生氯气的离子方程式:_____。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
编号 | 实验操作 | 实验现象 |
实验1 |
滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
实验2 |
滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
实验2的目的是:①______;②______。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
编号 | 实验操作 | 实验现象 |
实验3 |
逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
实验4 |
逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______。
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
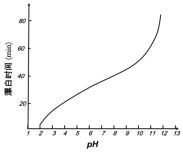
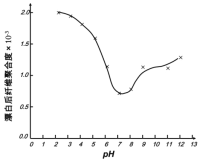
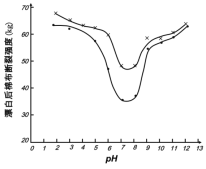
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____。
②综合考虑,生产过程中pH最好选择_____,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
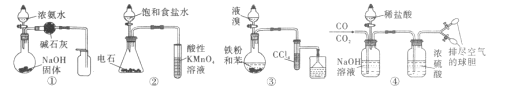
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有100mLHNO3溶液的烧杯中加入一定量的Cu、Al合金(还原产物为NO ),充分反应后向溶液中加入lmol/L的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如下图所示。则原HNO3溶液的物质的最浓度是

A. 0.4mol/L B. 0.45mol/L C. 0.525mol/L D. 0.625mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法不正确的是

A.CO2过量排放是导致温室效应的原因之一
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2-=CO32-
D.CO2最终转化为C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3—>I-,氧化性IO3—>I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是( )

A.0~a间发生反应3HSO3—+IO3—===3SO42—+I-+3H+
B.a~b间共消耗NaHSO3的物质的量为1.2 mol
C.b~c间发生的反应中I2既是氧化产物又是还原产物
D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为1.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.漂白粉溶液中通入过量的CO2:Ca2+ +2ClO- + CO2 +H2O = CaCO3↓+2HClO
B.实验室用MnO2和浓盐酸制取Cl2:MnO2 + 4HCl(浓)![]() Mn2+ +2Cl- + Cl2↑ + 2H2O
Mn2+ +2Cl- + Cl2↑ + 2H2O
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3- + Ba2+ + OH-= BaCO3↓+ H2O
D.钠和冷水反应:Na + 2H2O = Na+ + H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
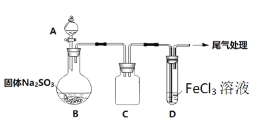
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com