
ˇľĚâÄżˇż(1)ÔÚ2LµÄĂܱŐČÝĆ÷ÖĐ·ĹČë4mol N2O5Ł¬·˘ÉúČçĎ·´Ó¦Łş2N2O5(g)![]() 4NO2(g)+O2(g)ˇŁ·´Ó¦ÖÁ5minʱŁ¬˛âµĂN2O5ת»ŻÁË20%Ł¬Ôňv(NO2)ÎŞ_________Ł»5minʱŁ¬N2O5ÔÚ»ěşĎĆřĚĺÖеÄĚĺ»ý·ÖĘýĘÇ____ˇŁ
4NO2(g)+O2(g)ˇŁ·´Ó¦ÖÁ5minʱŁ¬˛âµĂN2O5ת»ŻÁË20%Ł¬Ôňv(NO2)ÎŞ_________Ł»5minʱŁ¬N2O5ÔÚ»ěşĎĆřĚĺÖеÄĚĺ»ý·ÖĘýĘÇ____ˇŁ
(2)ijζČʱŁ¬ÔÚŇ»¸ö2LµÄĂܱŐČÝĆ÷ÖĐŁ¬Xˇ˘Yˇ˘ZČýÖÖÎďÖʵÄÎďÖʵÄÁżËćʱĽä±ä»ŻµÄÇúĎßČçÍĽËůĘľˇŁ¸ůľÝÍĽÖĐĘýľÝĚîżŐŁş
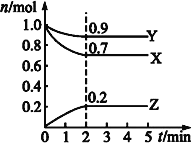
˘Ů¸Ă·´Ó¦µÄ»ŻŃ§·˝łĚʽΪ______ˇŁ
˘ÚČôXˇ˘Yˇ˘ZľůÎŞĆřĚ壬2minʱ·´Ó¦´ďµ˝Ć˝şâŁ¬´ËʱĚĺϵÄÚѹǿÓ뿪ʼʱµÄѹǿ֮±ČÎŞ____ˇŁ
˘ŰČôXˇ˘Yˇ˘ZľůÎŞĆřĚ壬Ôň´ďĆ˝şâʱŁ¬ČÝĆ÷ÄÚ»ěşĎĆřĚĺµÄĆ˝ľůĎŕ¶Ô·Ö×ÓÖĘÁż±ČĆđʼͶÁĎʱ__(ĚÔö´óˇ±ˇ°ĽőСˇ±»ňˇ°ĎŕµČˇ±)ˇŁ
ˇľ´đ°¸ˇż0.16 molˇ¤L-1ˇ¤min-1 61.5% 3X+Y![]() 2Z 9ˇĂ10 Ôö´ó
2Z 9ˇĂ10 Ôö´ó
ˇľ˝âÎöˇż
±ľĚâÖ÷ŇŞżĽ˛ě»ŻŃ§Ć˝şâˇŁ
(1) N2O5ת»ŻÁË20%Ł¬Ôň¦¤n(N2O5)=4molˇÁ20%=0.8molŁ¬ĚĺϵÖи÷×é·ÖµÄÎďÖʵÄÁżČçϱíËůĘľŁ¨µĄÎ»ŁşmolŁ©Łş
2N2O5 | 4NO2 | O2(g) | |
2 | 4 | 1 | |
Ćđ | 4 | 0 | 0 |
ת | 0.8 | 1.6 | 0.4 |
Ć˝ | 3.2 | 1.6 | 0.4 |
¦¤n(NO2)=1.6molŁ¬v(NO2)=![]() = 0.16 molˇ¤L-1ˇ¤min-1Ł»¸ůľÝ°˘·ü٤µÂÂ޶¨ÂɿɵãşN2O5ÔÚ»ěşĎĆřĚĺÖеÄĚĺ»ý·ÖĘýĘÇ
= 0.16 molˇ¤L-1ˇ¤min-1Ł»¸ůľÝ°˘·ü٤µÂÂ޶¨ÂɿɵãşN2O5ÔÚ»ěşĎĆřĚĺÖеÄĚĺ»ý·ÖĘýĘÇ![]() =61.5%Ł»
=61.5%Ł»
(2)˘Ů·´Ó¦ÖĐŁ¬Xˇ˘YµÄÎďÖʵÄÁżĽőСŁ¬ZµÄÎďÖʵÄÁżÔö¶ŕŁ¬ÔňXˇ˘YÎŞ·´Ó¦ÎZÎŞÉúłÉÎ0-2minÄÚŁ¬¦¤n(X)=0.3molŁ¬¦¤n(Y)=0.1molŁ¬¦¤n(Z)=0.2molŁ¬ÇŇ2minşó¸÷×é·ÖµÄÎďÖʵÄÁż˛»Ôٸı䣻ËůŇÔŁ¬¸Ă·´Ó¦µÄ»ŻŃ§·˝łĚʽΪ3X+Y![]() 2ZŁ»
2ZŁ»
˘Ú¸ůľÝŔíĎëĆřĚĺ״̬·˝łĚ:PV=nRTŁ¬2minʱĚĺϵѹǿÓ뿪ʼʱµÄѹǿ֮±ČµČÓÚÁ˝¸öʱĽäµÄĆřĚĺµÄ×ÜÎďÖʵÄÁżÖ®±ČŁ¬¸Ă±ČŔýÎŞŁ¨0.9+0.7+0.2Ł©ŁşŁ¨1.0+1.0Ł©=1.8Łş2=9Łş10Ł»
˘Ű¸Ă·´Ó¦µÄ»ŻŃ§·˝łĚʽΪ3X+Y![]() 2ZŁ¬·´Ó¦´ÓŐý·´Ó¦żŞĘĽŁ¬ÔňĚĺϵµÄ×ÜÎďÖʵÄÁżĽőСŁ¬ÓÉÓÚĚĺϵÖи÷×é·Ö¶ĽĘÇĆřĚ壬ÔňĚĺϵµÄ×ÜÖĘÁż˛»±äŁ¬»ěşĎĆřĚĺµÄĆ˝ľůĎŕ¶Ô·Ö×ÓÖĘÁżÔö´óˇŁ
2ZŁ¬·´Ó¦´ÓŐý·´Ó¦żŞĘĽŁ¬ÔňĚĺϵµÄ×ÜÎďÖʵÄÁżĽőСŁ¬ÓÉÓÚĚĺϵÖи÷×é·Ö¶ĽĘÇĆřĚ壬ÔňĚĺϵµÄ×ÜÖĘÁż˛»±äŁ¬»ěşĎĆřĚĺµÄĆ˝ľůĎŕ¶Ô·Ö×ÓÖĘÁżÔö´óˇŁ



| Ä꼶 | ¸ßÖĐżÎłĚ | Ä꼶 | łőÖĐżÎłĚ |
| ¸ßŇ» | ¸ßŇ»Ăâ·ŃżÎłĚÍĆĽöŁˇ | łőŇ» | łőŇ»Ăâ·ŃżÎłĚÍĆĽöŁˇ |
| ¸ß¶ţ | ¸ß¶ţĂâ·ŃżÎłĚÍĆĽöŁˇ | łő¶ţ | łő¶ţĂâ·ŃżÎłĚÍĆĽöŁˇ |
| ¸ßČý | ¸ßČýĂâ·ŃżÎłĚÍĆĽöŁˇ | łőČý | łőČýĂâ·ŃżÎłĚÍĆĽöŁˇ |
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżĽ×´ĽÓĂÍľČŐŇćąă·şŁ¬Ô˝Ŕ´Ô˝ŇýĆđÉ̼ҵĹŘעŁ¬ą¤ŇµÉϼ״ĽµÄşĎłÉÍľľ¶¶ŕÖÖ¶ŕŃůˇŁÔÚ![]() ĂܱŐČÝĆ÷ÄÚŁ¬
ĂܱŐČÝĆ÷ÄÚŁ¬![]() ʱ·´Ó¦Łş
ʱ·´Ó¦Łş![]()
![]() Ł¬ĚĺϵÖĐ
Ł¬ĚĺϵÖĐ![]() ËćʱĽäµÄ±ä»ŻČçĎÂ±íŁş
ËćʱĽäµÄ±ä»ŻČçĎÂ±íŁş
ʱĽä(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)ÍĽÖбíĘľ![]() µÄ±ä»ŻµÄÇúĎßĘÇ________ˇŁ
µÄ±ä»ŻµÄÇúĎßĘÇ________ˇŁ
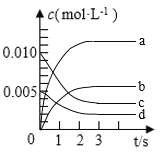
(2)ÓĂ![]() ±íĘľ´Ó0~2sÄڸ÷´Ó¦µÄĆ˝ľůËŮÂĘ
±íĘľ´Ó0~2sÄڸ÷´Ó¦µÄĆ˝ľůËŮÂĘ![]() ________
________![]() ˇŁ
ˇŁ
(3)ÄÜ˵Ă÷¸Ă·´Ó¦ŇѴﵽƽşâ״̬µÄĘÇ________ˇŁ
a.![]() Óë
Óë![]() µÄŨ¶Č±ŁłÖ˛»±ä b.ČÝĆ÷ÄÚĂܶȱŁłÖ˛»±ä
µÄŨ¶Č±ŁłÖ˛»±ä b.ČÝĆ÷ÄÚĂܶȱŁłÖ˛»±ä
c.ČÝĆ÷ÄÚѹǿ±ŁłÖ˛»±ä d.ĂżĎűşÄ![]() µÄͬʱÓĐ
µÄͬʱÓĐ![]() ĐÎłÉ
ĐÎłÉ
(4)ŇŃÖŞłŁÎÂłŁŃąĎÂ1gҺ̬Ľ×´ĽČĽÉŐÉúłÉ![]() ĆřĚĺşÍҺ̬ˮ·Ĺłö
ĆřĚĺşÍҺ̬ˮ·Ĺłö![]() µÄČČÁżŁ¬Ôň¸Ă·´Ó¦µÄČČ»ŻŃ§·˝łĚʽΪ________ˇŁ
µÄČČÁżŁ¬Ôň¸Ă·´Ó¦µÄČČ»ŻŃ§·˝łĚʽΪ________ˇŁ
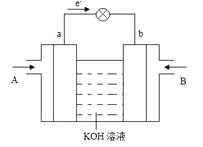
(5)![]() Óë
Óë![]() µÄ·´Ó¦żÉ˝«»ŻŃ§ÄÜת»ŻÎ޵çÄÜŁ¬Ć乤×÷ÔŔíČçĎÂÍĽËůĘľŁ¬ÍĽÖĐ
µÄ·´Ó¦żÉ˝«»ŻŃ§ÄÜת»ŻÎ޵çÄÜŁ¬Ć乤×÷ÔŔíČçĎÂÍĽËůĘľŁ¬ÍĽÖĐ![]() ´Ó________(ĚîA»ňB)ͨČ롣bµçĽ«·´Ó¦Ę˝ÎŞ________ˇŁ
´Ó________(ĚîA»ňB)ͨČ롣bµçĽ«·´Ó¦Ę˝ÎŞ________ˇŁ
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżĎŕͬζČĎÂŁ¬ČÝ»ýĎŕͬµÄĽ×ˇ˘Ňҡ˘±ű3¸öşăČÝĂܱŐČÝĆ÷ÖĐľů·˘Éú·´Ó¦Łş![]()
![]() ʵŃé˛âµĂÓĐąŘĘýľÝČçϱíËůĘľŁş
ʵŃé˛âµĂÓĐąŘĘýľÝČçϱíËůĘľŁş
ČÝĆ÷±ŕşĹ | ĆđĘĽ¸÷ÎďÖʵÄÎďÖʵÄÁż/mol | ´ďµ˝Ć˝şâʱĚĺϵÄÜÁżµÄ±ä»Ż/kJ | ||
|
|
| ||
Ľ× | 2 | 1 | 0 |
|
ŇŇ | 1.8 | 0.9 | 0.2 |
|
±ű | 0 | 0 | 2 |
|
ĎÂÁĐĹжĎÖĐŐýČ·µÄĘÇŁ¨ Ł©
A.![]()
B.ČôÉý¸ßζȣ¬·´Ó¦µÄČČЧӦ˛»±ä
C.![]()
D.ÉúłÉ![]() ʱ·ĹłöµÄČČÁż´óÓÚ98.5 kJ
ʱ·ĹłöµÄČČÁż´óÓÚ98.5 kJ
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżÄłĚţŔ໯şĎÎďAµÄÖĘĆ×ÍĽ±íĂ÷ĆäĎŕ¶Ô·Ö×ÓÖĘÁżÎŞ84Ł¬şěÍâąâĆ×±íĂ÷·Ö×ÓÖĐş¬ÓĐĚĽĚĽË«ĽüŁ¬şË´Ĺą˛ŐńÇâĆ×±íĂ÷·Ö×ÓÖĐÖ»ÓĐŇ»ÖÖŔŕĐ͵ÄÇ⡣
Ł¨1Ł©AµÄ˝áąąĽňʽΪ_____ˇŁ
Ł¨2Ł©AÖеÄĚĽÔ×ÓĘÇ·ń¶Ľ´¦ÓÚͬһƽĂ棿_____(ĚĘǡ±»ňˇ°˛»Ęǡ±)ˇŁ
Ł¨3Ł©ÔÚĎÂÍĽÖĐŁ¬D1ˇ˘D2»ĄÎŞÍ¬·ÖŇěąąĚ壬E1ˇ˘E2»ĄÎŞÍ¬·ÖŇěąąĚ塣
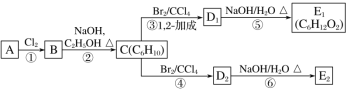
CµÄ»ŻŃ§ĂűłĆĘÇ______Ł»·´Ó¦˘ÝµÄ»ŻŃ§·˝łĚʽΪ______Ł»E2µÄ˝áąąĽňĘ˝ĘÇ___________Ł»˘Üˇ˘˘ŢµÄ·´Ó¦ŔŕĐÍŇŔ´Î_______ˇ˘______ˇŁ
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇż·´Ó¦N2(g)Ł«3H2(g)![]() 2NH3(g) ¦¤HŁĽ0Ł¬ČôÔÚşăŃąľřČČČÝĆ÷ÖĐ·˘ÉúŁ¬ĎÂÁĐѡĎî±íĂ÷·´Ó¦Ň»¶¨ŇŃ´ďĆ˝şâ״̬µÄĘÇŁ¨ Ł©
2NH3(g) ¦¤HŁĽ0Ł¬ČôÔÚşăŃąľřČČČÝĆ÷ÖĐ·˘ÉúŁ¬ĎÂÁĐѡĎî±íĂ÷·´Ó¦Ň»¶¨ŇŃ´ďĆ˝şâ״̬µÄĘÇŁ¨ Ł©
A. ČÝĆ÷ÄÚµÄζȲ»Ôٱ仯
B. ČÝĆ÷ÄÚµÄѹǿ˛»Ôٱ仯
C. ĎŕͬʱĽäÄÚŁ¬¶ĎżŞHŁHĽüµÄĘýÄżşÍÉúłÉNŁHĽüµÄĘýÄżĎŕµČ
D. ČÝĆ÷ÄÚĆřĚĺµÄŨ¶Čc(N2)ˇĂc(H2)ˇĂc(NH3)Ł˝1ˇĂ3ˇĂ2
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇż2SO2(g) + O2(g) ![]() 2SO3(g)ĘÇą¤ŇµÖĆÁňËáµÄÖ÷ŇŞ·´Ó¦Ö®Ň»ˇŁŇ»¶¨Î¶ČĎÂŁ¬Ôڼס˘Ňҡ˘±űČý¸öČÝ»ýľůÎŞ2 LµÄşăČÝĂܱŐČÝĆ÷ÖĐͶČëSO2(g)şÍO2(g)Ł¬ĆäĆđĘĽÎďÖʵÄÁżĽ°SO2µÄĆ˝şâת»ŻÂĘČçϱíËůĘľˇŁĎÂÁĐĹжĎÖĐŁ¬ŐýČ·µÄĘÇ
2SO3(g)ĘÇą¤ŇµÖĆÁňËáµÄÖ÷ŇŞ·´Ó¦Ö®Ň»ˇŁŇ»¶¨Î¶ČĎÂŁ¬Ôڼס˘Ňҡ˘±űČý¸öČÝ»ýľůÎŞ2 LµÄşăČÝĂܱŐČÝĆ÷ÖĐͶČëSO2(g)şÍO2(g)Ł¬ĆäĆđĘĽÎďÖʵÄÁżĽ°SO2µÄĆ˝şâת»ŻÂĘČçϱíËůĘľˇŁĎÂÁĐĹжĎÖĐŁ¬ŐýČ·µÄĘÇ
Ľ× | ŇŇ | ±ű | ||
ĆđĘĽÎďÖʵÄÁż | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2µÄĆ˝şâת»ŻÂĘ / % | 80 | ¦Á1 | ¦Á2 | |
A. Ľ×ÖĐ·´Ó¦µÄĆ˝şâłŁĘýСÓÚŇŇ
B. Ć˝şâʱŁ¬±űÖĐc(SO3)ĘÇĽ×ÖеÄ2±¶
C. ¸ĂζČĎÂŁ¬Ć˝şâłŁĘýֵΪ400
D. Ć˝şâʱŁ¬Ľ×ÖĐO2µÄת»ŻÂĘ´óÓÚŇŇÖĐO2µÄת»ŻÂĘ
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżČËą¤ąâşĎϵͳװÖĂŁ¨ČçÍĽŁ©żÉʵĎÖŇÔCO2şÍ H2O şĎłÉCH4ˇŁĎÂÁĐÓĐąŘ˵·¨˛»ŐýČ·µÄĘÇŁ¨Ł©

A. ¸Ă×°ÖĂÖĐÍÎŞŐýĽ«
B. µçłŘą¤×÷ʱH+ĎňCuµçĽ«ŇƶŻ
C. GaN µçĽ«±íĂćµÄµçĽ«·´Ó¦Ę˝ÎŞ: 2H2O-4e-¨TO2+4H+
D. ·´Ó¦CO2+2H2O¨TCH4+2O2ÖĐĂżĎűşÄ 1mol CO2תŇĆ 4mol e-
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżŇÔŇŇĎ©ÎŞÔÁĎŁ¬ÔÚŇ»¶¨ĚőĽţĎÂżÉŇÔת»ŻÎŞAˇ˘Bˇ˘CŁ¬×îşóşĎłÉÓĐąűĎăµÄDŁ¬×Ş»ŻąŘϵČçĎÂÍĽËůĘľˇŁ
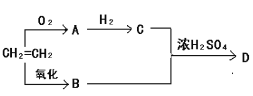
(1)Đ´łöÎďÖĘAÖеĹŮÄÜÍĹĂűłĆ_____Ł»
(2)CH2=CH2ÓëB·´Ó¦Ň˛żÉŇÔÉúłÉDŁ¬¸Ă·´Ó¦µÄ·´Ó¦ŔŕĐÍĘôÓÚ_____Ł»
(3)Đ´łöB+CˇúDµÄ·˝łĚĘ˝___Ł»
(4)ĎÂÁĐ˵·¨˛»ŐýČ·µÄĘÇ____ˇŁ
AŁ®CH2=CH2ÄÜÓëäĺË®şÍËáĐÔ¸ßĂĚËáĽŘČÜŇş·´Ó¦Ł¬Á˝ŐßµÄÍĘÉ«ÔŔí˛»Ďŕͬ
BŁ®ÎďÖĘAÓëĐÂÖĆCu(OH)2Đü×ÇŇş»ěşĎşóĽÓČČŁ¬żÉŇÔłöĎÖשşěÉ«łÁµí
CŁ®ĘµŃéĘŇÖƱ¸ÎďÖĘDʱŁ¬łŁÓñĄşÍNa2CO3ČÜŇşĘŐĽŻ˛úÎÇŇÓĐ»ú˛ăÔÚĎ²ă
DŁ®µČÎďÖʵÄÁżµÄCH2=CH2şÍCÍęČ«ČĽÉŐŁ¬şÄŃőÁżĎŕͬ
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş ĚâĐÍŁş
ˇľĚâÄżˇżµç¶Żą«˝»łµĚć´úČĽÓÍą«˝»łµĘÇ˝ÚÄÜĽőĹš˘żŘÖĆÎíö˛µÄÖŘŇŞľŮ´ë֮һŁ¬ĎÂÍĽËůĘľµçłŘĘÇŇ»ÖÖŐýÔÚżŞ·˘µÄłµÔصçłŘˇŁÓйظõçłŘµÄ˵·¨ŐýČ·µÄĘÇ
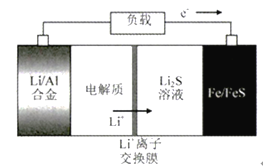
A. ·ĹµçʱFe/FeSĽ«ĘǸşĽ«
B. ·Ĺµçʱ¸şĽ«·´Ó¦Ę˝ÎŞŁşAl-3e-=Al3+
C. łäµçʱŃôĽ«·´Ó¦Ę˝ÎŞŁşFe+S2--2e-=FeS
D. ×ó±ßµç˝âÖĘżÉŇÔĘÇLiOHµÄ´ĽČÜŇş
˛éż´´đ°¸şÍ˝âÎö>>
ąúĽĘѧУÓĹѡ - Á·Ď°˛áÁбí - ĘÔĚâÁбí
şţ±±Ęˇ»ĄÁŞÍřÎĄ·¨şÍ˛»ÁĽĐĹϢľŮ±¨Ć˝Ě¨ | ÍřÉĎÓĐş¦ĐĹϢľŮ±¨×¨Çř | µçĐĹթƾٱ¨×¨Çř | ÉćŔúĘ·ĐéÎŢÖ÷ŇĺÓĐş¦ĐĹϢľŮ±¨×¨Çř | ÉćĆóÇÖȨľŮ±¨×¨Çř
ÎĄ·¨şÍ˛»ÁĽĐĹϢľŮ±¨µç»°Łş027-86699610 ľŮ±¨ÓĘĎ䣺58377363@163.com