
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | Na2S或H2S等 | | | | SO2或Na2SO3 | | |
 H++SO32-、HSO3-+H2O
H++SO32-、HSO3-+H2O H2SO3+OH-、H2O
H2SO3+OH-、H2O H++OH-;(3分,每个方程式1分)
H++OH-;(3分,每个方程式1分) H++SO32-、HSO3-+H2O
H++SO32-、HSO3-+H2O H2SO3+OH-、H2O
H2SO3+OH-、H2O H++OH-,
H++OH-,

科目:高中化学 来源:不详 题型:单选题
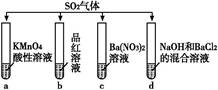
| A.试管a中实验可以证明SO2具有漂白性 |
| B.试管b中溶液褪色,说明SO2具有强氧化性 |
| C.试管c中能产生白色沉淀,说明SO2具有还原性 |
| D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
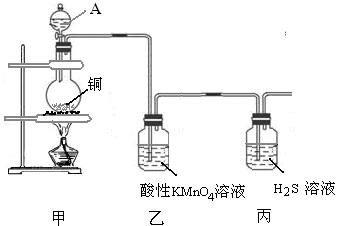
查看答案和解析>>
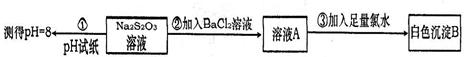
科目:高中化学 来源:不详 题型:单选题
| A.BaSO4 | B.BaSO3 | C.BaS | D.BaSO4和BaSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下均可用铝制容器运输 |
| B.露置在空气中,容器内酸液质量都减小 |
| C.常温下均能与铜较快反应 |
| D.露置在空气中,容器内酸液质量都增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2 | B.NH3 | C.NO2 | D.Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因浓硫酸具有强氧化性,故不可用它来干燥氢气 |
| B.浓硫酸与浓氨水靠近时产生大量白烟 |
| C.浓硫酸有强氧化性,稀硫酸不具有氧化性 |
| D.浓硫酸具有腐蚀性,取用时要小心 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.产生BaSO4沉淀 | B.产生BaSO3沉淀 |
| C.产生BaSO4与BaSO3的混合沉淀 | D.无沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
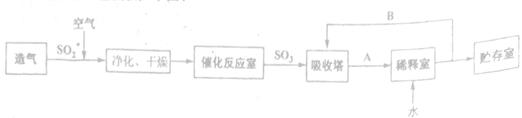
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com