
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是 。
(2)混合气体的平均摩尔质量是 。
(3)CO2和CO的体积之比是 。
(4)CO的体积分数是 。
(5)CO2和CO的质量之比是 。
(6)CO的质量分数是 。
(7)混合气体中所含氧原子的物质的量是 。
(8)混合气体中所含碳原子的物质的量是 。
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:单选题
下列各组物质中分子数相同的是( )
| A.2LCO和2LCO2 |
| B.9gH2O和标准状况下11.2LCO2 |
| C.标准状况下1molO2和22.4LH2O |
| D.0.2molH2和4.48LHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)取14.3g Na2CO3?XH2O 溶于水配成100m L 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 20.0m L,并收集到1.12 L CO2(标准状况)。试计算:
(1)稀盐酸物质的量浓度为 mol/L;
(2)x值是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: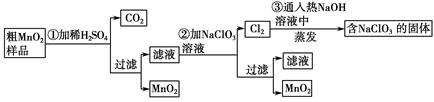
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温 度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量
浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______________________为__________________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中__________为________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为
b g·mL-1,则该盐酸的物质的量的浓度是________。
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ________。
(3)FeCl3溶液可以用来净水,其净水的原理为____________________ _____________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有铵盐样品A,是(NH4)2SO4、NH4HSO4的混合物。为确定A中各成分的含量,某研究性学习小组的同学取了数份相同质量的样品A溶于水,然后分别加入不同体积的1 mol/L的NaOH溶液,水浴加热至气体全部逸出(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图所示。分析该图象并回答下列问题: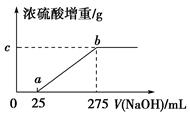
(1)写出ab段涉及的离子方程式:_____________________________。
(2)c点对应的数值是________;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com