
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
已知25%的氨水的密度为0.91 g/ml,5%的氨水密度为0.98 g/ml,若将上述两种氨水等体积混合,所得氨水的质量分数 ( )
| A.等于15% | B.大于15% | C.小于15% | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)写出反应①的化学方程式: 。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂 。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是 。
(2)混合气体的平均摩尔质量是 。
(3)CO2和CO的体积之比是 。
(4)CO的体积分数是 。
(5)CO2和CO的质量之比是 。
(6)CO的质量分数是 。
(7)混合气体中所含氧原子的物质的量是 。
(8)混合气体中所含碳原子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: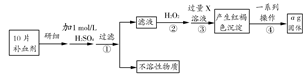
请回答下列问题:
(1)步骤②加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中的一系列操作依次为:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。反应原理为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为 ;
②上述实验中的KMnO4溶液需要酸化,可用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: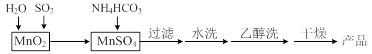
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com