
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
科目:高中化学 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )

(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的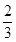 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: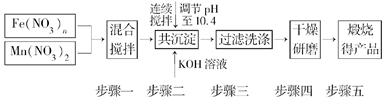
(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4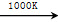 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有铵盐样品A,是(NH4)2SO4、NH4HSO4的混合物。为确定A中各成分的含量,某研究性学习小组的同学取了数份相同质量的样品A溶于水,然后分别加入不同体积的1 mol/L的NaOH溶液,水浴加热至气体全部逸出(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图所示。分析该图象并回答下列问题: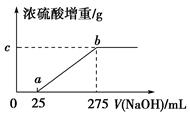
(1)写出ab段涉及的离子方程式:_____________________________。
(2)c点对应的数值是________;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3 g;(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取1.43 g Na2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标况)。
求:(1)稀盐酸物质的量浓度为 mol?L-1
(2)Na2CO3?xH2O的摩尔质量为 g?mol-1
(3)x=
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com