
取1.43 g Na2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标况)。
求:(1)稀盐酸物质的量浓度为 mol?L-1
(2)Na2CO3?xH2O的摩尔质量为 g?mol-1
(3)x=
(1)5 (2)286 (3)10
解析试题分析:根据反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O计算;n(CO2)=0.005mol,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)=5.0mol/L,
(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,
(3)由摩尔质量可知:106+18x=286,x=10。
考点:考查化学方程式的计算


科目:高中化学 来源: 题型:填空题
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: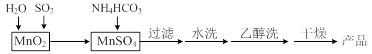
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______为______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中______为______。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中______为______。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中______为______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现用98%的浓H2SO4(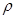 =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加水至刻度 |
| D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某小组用铜屑制取硫酸铜溶液。将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气其反应原理为2Cu+O2+2H2SO4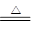 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
(1)参加反应的氧气在标准状况下的体积是 。
(2)所得硫酸铜溶液的物质的量浓度是 。
(3)取100 mL上述硫酸铜溶液,加水稀释至0.1 mol/L,稀释后硫酸铜溶液的体积是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水; ②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠; ④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:
将该反应设计为原电池,负极电极反应为 ,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为 。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为 。溶解样品若选择稀硝酸测定结果 (填偏高,偏低,无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com