
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
①2H++ SO42—+ Ba2+ + 2OH—=BaSO4↓+2H2O 0.067 ②100; 0.1
解析试题分析:n(H+)="0.1×0.1×2=0.02(" mol),n(SO42-)="0.1×0.1" +0.1×0.1 ="0.02(" mol);n(Ba2+)="0.2×0.05=0.01(" mol),n (OH-)="0.2×0.05×2=0.02(" mol),所以反应实质是H2SO4和Ba(OH)2溶液反应。离子方程式是:2H++ SO42—+ Ba2+ + 2OH—=Ba SO4 ↓+2 H2O。反应后的溶液为Na2SO4溶液其浓度为:C(Na2SO4)=n∕V=0.1×0.1mol∕0.15L=0.067mol∕L.当SO42—+完全反应时沉淀达到最大值,这时n(SO42-)=n(Ba2+)="0.02" mol,V(Ba(OH)2)=0.02mol÷0.2 mol∕L=0.1L=100ml.此时溶液为NaOH溶液,n(NaOH)=n(Na+)=0.1×0.1×2="0.02(" mol),C(NaOH)= =n∕V=0.02mol∕0.2L=0.1mol∕L
考点:考查离子反应随反应物的量的关系等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
取1.43 g Na2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标况)。
求:(1)稀盐酸物质的量浓度为 mol?L-1
(2)Na2CO3?xH2O的摩尔质量为 g?mol-1
(3)x=
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学计量在化学中占有重要地位,请回答下列问题:
(1)标准状况下6.72 L NH3分子中所含原子数与 mL H2O所含原子数相等。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(3)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。(用a、b、V表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: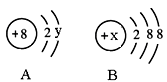
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
17克NH3共有 mol电子,0.1molH2S共有约 个分子,
同温同压下,同体积的NH3和H2S气体的质量比为 ;
同温同压下,同质量的NH3和H2S气体的体积比为 ;
同质量的NH3和H2S中氢原子的个数比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热: 。
(2)将CO2通入苯酚钠溶液中: 。
(3)1,3-丁二烯的与Br2的1、4加成反应: 。
(4)葡萄糖与银氨溶液发生银镜反应: 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取2.000g样品在空气中充分灼烧(假设杂质不参加反应),将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.3360mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液25.00mL。
已知:①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②SO2+2Fe3++2H2O→SO42-+2Fe2++4H+
③MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
(1)样品中FeS2的质量分数是 。(用小数表示,保留三位,下同)
(2)煅烧1000 t该黄铁矿生产出997.9 t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为 。
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO3。把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为0.200的SO3)。计算吸收106 m3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知在20℃时,每100g水溶解0.148g Ca(OH)2即达饱和。
(1)在20℃500g水中加入7.4g Ca(OH)2粉末,经充分搅拌后过滤,若液体体积仍为500mL,
求OH-离子的物质的量浓度。
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol·L-1,求需要通入标准状况下二氧化碳气体
多少升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com