
已知在20℃时,每100g水溶解0.148g Ca(OH)2即达饱和。
(1)在20℃500g水中加入7.4g Ca(OH)2粉末,经充分搅拌后过滤,若液体体积仍为500mL,
求OH-离子的物质的量浓度。
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol·L-1,求需要通入标准状况下二氧化碳气体
多少升?
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中 和
和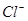 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将117 g NaCl溶于水配制成1 L溶液,回答下列问题:
(1)该溶液中NaCl的物质的量浓度为多少 ?
(2)配制1mol·L-1的NaCl溶液500mL,需要该溶液的体积为多少?
(3)向(2)所配制的溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L- 1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2  Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
A是 (写化学式)。若得到192克的硫磺,则产生标准状况下的A气体 L。
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为 。
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程。(不考虑硫化氢的分解)
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3?5H2O多少克?写出推导过程。(已知:Na2S2O3的溶解度,10℃时为60.0g/100g水,100℃时为207g/100g水。100℃时,Na2S2O3饱和溶液的密度为1.14g/mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为: (注明你的表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com