
现用98%的浓H2SO4(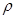 =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加水至刻度 |
| D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 |
(1)AEFDCB;(2)①13.6 ②15 偏低 ③防止暴沸,使稀释浓硫酸产生的热量及时散发出去 偏低 ④ 静置冷却 偏高 偏低 ⑤偏高 偏低(每一个空1分)
解析试题分析:(1)本题考查一定物质的量浓度溶液配制的操作步骤;操作步骤有计算、量取、溶解、移液、洗涤、定容、摇匀等操作,其操作正确顺序为AEFDCB;(2)①根据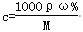 计算浓H2SO4的物质的量浓度为18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x=13.6mL;②量取13.6mL浓硫酸,需要使用15mL的量筒;量取时发现量筒不干净用水洗净后直接量取,浓硫酸被蒸馏水稀释,导致浓硫酸的浓度偏低,将使实验最终结果偏低;③浓硫酸稀释放热,将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是防止暴沸,使稀释浓硫酸产生的热量及时散发出去,若搅拌过程中有液体溅出,溶质损失,会使最终结果偏低;④浓硫酸稀释放热,溶液的温度升高,转移前必须冷却稀释的溶液,否则冷却后配制的溶液的体积偏低,最终导致浓度偏高;洗涤烧杯和玻璃棒2~3次,洗液也要转入容量瓶,否则会使配制的溶液中溶质的物质的量减小,浓度偏低;⑤定容时俯视,导致溶液体积偏小,所配溶液的浓度偏高;若仰视,导致溶液的体积偏大,配制的溶液浓度偏低。
计算浓H2SO4的物质的量浓度为18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x=13.6mL;②量取13.6mL浓硫酸,需要使用15mL的量筒;量取时发现量筒不干净用水洗净后直接量取,浓硫酸被蒸馏水稀释,导致浓硫酸的浓度偏低,将使实验最终结果偏低;③浓硫酸稀释放热,将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是防止暴沸,使稀释浓硫酸产生的热量及时散发出去,若搅拌过程中有液体溅出,溶质损失,会使最终结果偏低;④浓硫酸稀释放热,溶液的温度升高,转移前必须冷却稀释的溶液,否则冷却后配制的溶液的体积偏低,最终导致浓度偏高;洗涤烧杯和玻璃棒2~3次,洗液也要转入容量瓶,否则会使配制的溶液中溶质的物质的量减小,浓度偏低;⑤定容时俯视,导致溶液体积偏小,所配溶液的浓度偏高;若仰视,导致溶液的体积偏大,配制的溶液浓度偏低。
考点:考查一定物质的量浓度溶液的配制。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: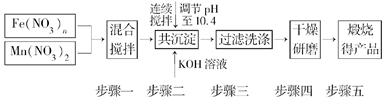
(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4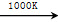 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3 g;(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取1.43 g Na2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标况)。
求:(1)稀盐酸物质的量浓度为 mol?L-1
(2)Na2CO3?xH2O的摩尔质量为 g?mol-1
(3)x=
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率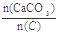 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(3)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: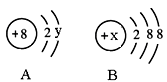
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com